La COVID-19 es la enfermedad causada por un coronavirus, SARS-CoV-2. La Organización Mundial de la Salud (OMS) tuvo noticia por primera vez de la existencia de este nuevo virus el 31 de diciembre de 2019, al ser informada de un grupo de casos de neumonía atípica que se habían declarado en Wuhan (República Popular China)1. Hasta el 04 de marzo de 2022 se han reportado 443,065,212 casos de COVID-19 en todo el mundo y un total de 5,988,519 defunciones. Para la misma fecha, en México se han notificado 5,544,644 casos y 319,296 defunciones2.
Los pacientes con COVID-19 pueden experimentar una variedad de manifestaciones clínicas, desde cursar asintomáticos hasta una enfermedad crítica. De acuerdo a los National Institutes of Health (NIH), los adultos con infección por SARS-CoV-2 se pueden agrupar en los siguientes categorías de gravedad de la enfermedad.3
Se han identificado ciertas condiciones de salud que se asocian con alto riesgo de progresión a COVID-19 grave3-4 y que deben ser priorizados para tratamiento. Entre estas se encuentran:
• Inmunosupresión grave independiente del estado de la vacuna (ver anexo 1)
• Personas no vacunadas con comorbilidades asociadas a mayor riesgo de enfermedad grave (ver anexo 2)
• Mayores de 65 años con vacunación incompleta
• Mayores de 65 años vacunas y con comorbilidades asociadas a mayor riesgo de enfermedad grave.
RECOMENDACIONES DE TRATAMIENTO CON ANTIVIRALES
Las recomendaciones que emitimos tienen como base las guías de los National Institutes of Health (NIH), la Infectious Disease Society of America (IDSA) y la Guía Clínica para el tratamiento de la Covid-19 en México, que actualmente emiten recomendaciones de tratamiento para pacientes con COVID-19 ambulatorios y hospitalizados.3-6 Nos enfocaremos a las opciones de tratamiento antiviral.
Molnupiravir
El molnupiravir (MK-4482, EIDD-2801) es un fármaco antiviral, que es el profármaco biodisponible por vía oral del análogo de ribonucleósido N4-hidroxicitidina (NHC, EIDD-1931) que inhibe la replicación de múltiples virus de ARN, incluido el SARS-CoV-2, al introducir errores de copia durante la replicación del ARN viral.7
El ensayo clínico MOVe-OUT (MK-4482-002) (NCT04575597) es un estudio global de fase 3, aleatorizado, controlado con placebo, doble ciego y en múltiples sitios de pacientes adultos no hospitalizados con síntomas leves a moderados por COVID-19 confirmado. Los pacientes inscritos en el estudio no estaban vacunados contra el SARS-CoV-2, tenían al menos un factor de riesgo asociado para desarro-
llar enfermedad grave y con síntomas de COVID-19 dentro de los cinco días anteriores a la aleatorización. El objetivo principal de eficacia de MOVe-OUT fue evaluar la eficacia del molnupiravir en comparación con placebo según la evaluación del porcentaje de participantes que son hospitalizados y/o mueren desde el momento de la aleatorización hasta el día 29. En el análisis intermedio, molnupiravir redujo el
riesgo de hospitalización o muerte en aproximadamente un 50%. El 7,3% de los pacientes que recibieron molnupiravir fueron hospitalizados o murieron hasta el día 29 después de la aleatorización (28/385), en comparación con el 14,1% de los pacientes tratados con placebo (53/377); p = 0,0012. Hasta el día 29, no se informaron muertes en pacientes que recibieron molnupiravir, en comparación con 8 muertes en pacientes que recibieron placebo. Por recomendación de un Comité de Monitoreo de Datos independiente y en consulta con la Administración de Drogas y Alimentos de los EE. UU. (FDA), el reclutamiento para el estudio se detuvo anticipadamente debido a estos resultados positivos.8
Recomendaciones:
• Recomendamos molnupiravir en pacientes no hospitalizados de ≥18 años con COVID-19 confirmado de leve a moderado y que tienen alto riesgo de progresión a enfermedad grave.
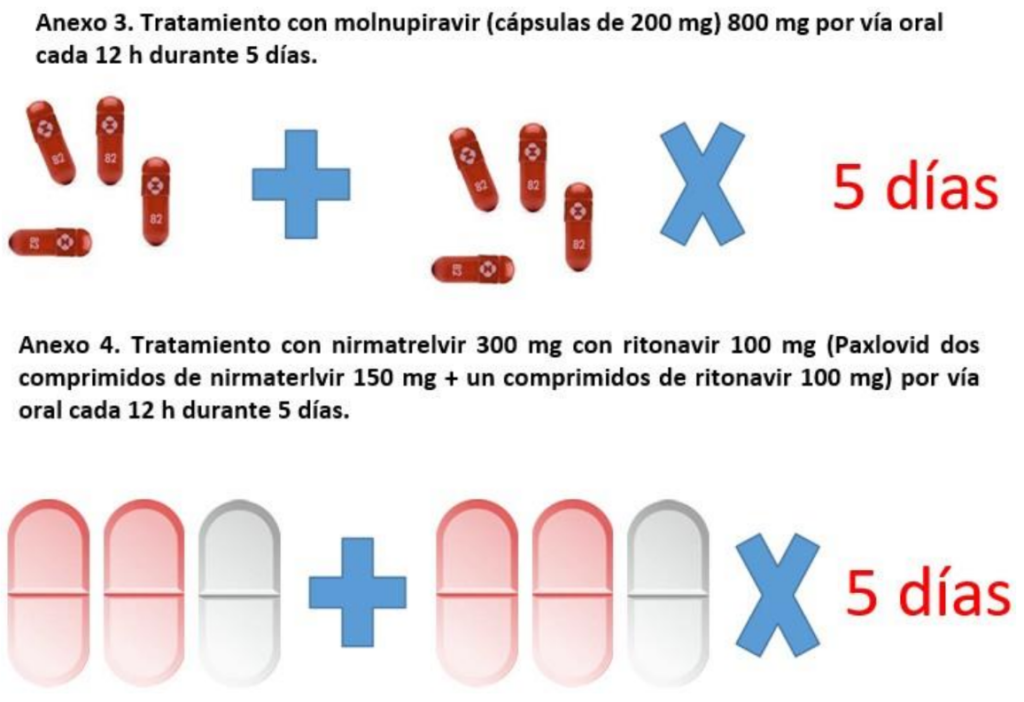
• Recomendamos molnupiravir 800 mg por vía oral cada 12h durante 5 días (Anexo 3).
• El tratamiento debe iniciarse lo antes posible y dentro de los 5 días del inicio de los síntomas.
• No se recomienda el uso de molnupiravir en pacientes embarazadas ya que se ha reportado toxicidad fetal en estudios con animales tratados con molnupiravir.
• Las personas sexualmente activas en edad fértil con posibilidad de concepción, debe usar algún método de anticoncepción durante y después del tratamiento con molnupiravir. Se recomienda algún método anticonceptivo por lo menos 3 meses.

• En pacientes hospitalizados por otra razón a infección por SARS-CoV-2, que durante el internamiento se diagnostiquen con COVID-19 de leve a moderado, se puede considerar utilizar este tratamiento.
Nirmatrelvir/ ritonavir (paxlovid)
El nirmatrelvir es un fármaco antiviral que se dirige a la enzima 3-quimotripsina tipo cisteína proteasa del SARSCoV-2 (Mpro). Este objetivo es fundamental en la replicación del ciclo viral. Este nuevo antiviral mostró una potente inhibición de la actividad de Mpro y la replicación del virus invitro. La coadministración de nirmatrelvir con ritonavir, un inhibidor de CYP3A4, mejora la farmacocinética de nirma-
trelvir9.
El ensayo EPIC-HR (Evaluation of Protease Inhibition for Covid-19 in High-Risk Patients) evaluó la seguridad y eficacia de nirmatrelvir más ritonavir en adultos no hospitalizados con covid-19 de leve a moderado con alto riesgo de progresión a enfermedad grave. Este fue un ensayo controlado, aleatorizado, doble ciego, de fase 2-3 en el que adultos sintomáticos, no vacunados y no hospitalizados con alto riesgo de progresión a enfermedad grave por COVID-19 fueron aleatorizados en una proporción de 1:1 para recibir 300 mg
de nirmatrelvir más 100 mg de ritonavir o placebo cada 12 horas durante 5 días. Un total de 2246 pacientes fueron aleatorizados. La incidencia de hospitalización o muerte relacionada con COVID-19 para el día 28 fue menor en el grupo de nirmatrelvir que en el grupo de placebo en 6,32 puntos porcentuales (intervalo de confianza [IC] del 95 %, −9,04 a −3,59; P<0,001; reducción del riesgo relativo, 89,1 %). Hubieron 13 muertes, todas ocurrieron en el grupo de placebo10.
El 22 de diciembre de 2021, la FDA emitió una autorización de uso de emergencia para nirmatrelvir potenciado con ritonavir para el tratamiento de pacientes con COVID-19 de leve a moderado en ≥12 años y con un peso de ≥40 kg que se encuentren dentro de los 5 días posteriores al inicio de los síntomas y con alto riesgo de progresar a una enfermedad grave11.
Recomendaciones:
• Recomendamos nirmatrelvir potenciado con ritonavir para el tratamiento de pacientes no hospitalizados con COVID-19 de leve a moderado en ≥12 años y con un peso de ≥40 kg y con alto riesgo de progresar a una enfermedad grave.
• Recomendamos nirmatrelvir 300 mg con ritonavir 100 mg (Paxlovid) por vía oral cada 12 h durante 5 días (Anexo 4).
• El tratamiento debe iniciarse lo antes posible y dentro de los 5 días del inicio de los síntomas.
• Recomendamos que antes de indicar nirmatrelvir potenciado con ritonavir, se deben revisar detenidamente las posibles interacciones entre medicamentos, suplementos o drogas recreativas. El sitio web “Liverpool COVID-19 Drug Interactions” se puede utilizar para identificar y controlar las interacciones farmacológicas.
• La dosis debe ajustarse a nirmatrelvir 150 mg con ritonavir 100 mg dos veces al día en pacientes con insuficiencia renal moderada (aquellos con una tasa de filtración glomerular estimada [TFG] de ≥30 a <60 ml/min). No se recomienda en pacientes con una TFG de <30 ml/min.
En pacientes hospitalizados por otra razón a infección por SARS-CoV-2, que durante el internamiento se diagnostiquen con COVID-19 de leve a moderado, se puede considerar utilizar este tratamiento.
Remdesivir
Remdesivir es un profármaco de nucleótidos de un análogo de adenosina. Se une a la polimerasa de ARN dependiente de ARN viral e inhibe la replicación viral al interrumpir prematuramente la transcripción de ARN12. El remdesivir intravenoso está aprobado por la FDA para el tratamiento de COVID-19 en pacientes adultos y pediátricos (≥12 años y peso ≥40 kg)13.
El estudio PINETREE exploró la eficacia remdesivir en pacientes sintomáticos no hospitalizados con Covid-19 y que tenían un alto riesgo de la progresión de la COVID-19. Este ensayo aleatorizado, doble ciego, controlado con placebo incluyó a pacientes con un inicio de síntomas en los últimos 7 días y que tenían al menos un factor de riesgo de progresión de la enfermedad (edad ≥60 años, obesidad, o ciertas condiciones médicas coexistentes). Los pacientes fueron asignados aleatoriamente para recibir remdesivir intraveno-
so (200 mg el día 1 y 100 mg el día 2 y 3). Los resultados sugieren que hay una reducción en la hospitalización relacionada con COVID-19 y las visitas médicas relacionadas con COVID-19 dentro de los 28 días entre los tratados con remdesivir en comparación con el placebo. El beneficio absoluto de remdesivir sería potencialmente menor entre personas vacunadas14
El National Institute for Health and Care Excellence del Reino Unido, realizó un revisión de 4 ensayos controlados aleatorios principales que compararon remdesivir con atención estándar en adultos hospitalizado con COVID-19. Al analizar la mortalidad por cualquier causa se encontró que remdesivir reduce la mortalidad en el día 28 en personas hospitalizadas que no requieren oxígeno o requieren un flujo bajo en comparación con la atención estándar, pero la estimación no es estadísticamente significativa (25 menos muertes por cada 1000 personas[RR 0,72, IC del 95 %: 0,52 a 1,01; 6318 personas en 4 estudios])15.
Recomendaciones:
• Recomendamos Remdesivir en pacientes no hospitalizados con COVID-19 de leve a moderado, adultos y pediátricos (≥12 años y peso ≥40 kg) con alto riesgo de progresar a una enfermedad grave.
• Recomendamos tratamiento con remdesivir por 3 días (200 mg el día 1 y 100 mg los días 2 y 3).
• El tratamiento debe iniciarse lo antes posible y recomendamos que preferentemente sea dentro de los 5 días del inicio de los síntomas.
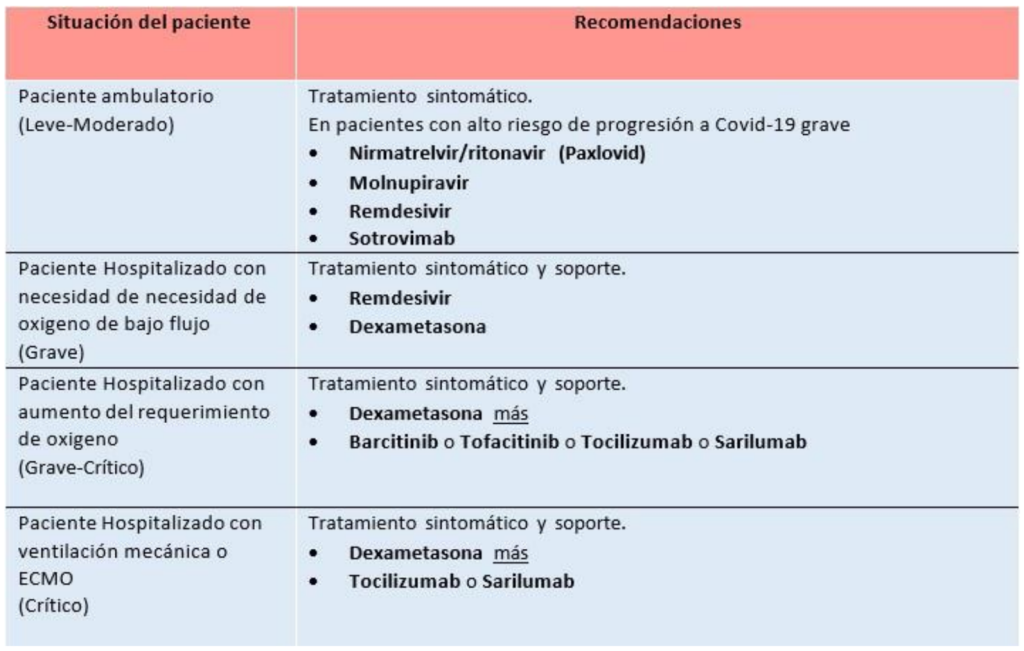
*Los anticuerpos monoclonales y fármacos antivirales están recomendados bajo aprobación de emergencia.


• Recomendamos considerar remdesivir (hasta 5 días de tratamiento) para pacientes hospitalizados con neumonía y necesidad oxígeno suplementario de bajo flujo. Para esta recomendación considerar disponibilidad y preferentemente dentro de los de los 7 días del inicio de los
síntomas.
• En pacientes hospitalizados por otra razón a infección por SARS-CoV-2, que durante el internamiento se diagnostiquen con COVID-19 de leve a moderado, se puede considerar utilizar este tratamiento.
permiten el uso sin restricciones, distribución y reproducción en cualquier medio o formato, siempre que se le dé la atribución al creador. Si remezcla,
adapta o construye sobre el material, debe licenciar el material modificado bajo términos idénticos.
REFERENCIAS
- Información básica sobre la COVID-19. Organización Mundial de la Salud 2020. Disponible en: https://www.who.int/es/emergencies/diseases/novel-coronavirus- 2019/advice-for-public/q-a-coronaviruses
- Johns Hopkins. COVID-19 Dashboard by the Center for Science and Engineering. 2021. Disponible en: https://coronavirus.jhu.edu/map.html. Consultado el 22 de noviembre de 2021.
- COVID-19 Treatment Guidelines Panel. Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. National Institutes of Health. Disponible en https://www.covid19treatmentguidelines.nih.gov/.
- Rosenthal N, Cao Z, Gundrum J, Sianis J, Safo S. Risk factors associated with in- hospital mortality in a US national sample of patients with COVID-19. JAMA Netw Open. 2020;3(12):e2029058
- Infectious Diseases Society of America Guidelines on the Treatment and Management of Patients with COVID-19. Infectious Diseases Society of America 2021; Version 5.6.0. Disponible en https://www.idsociety.org/practice- guideline/covid-19-guideline-treatment-and-management/.
- Guía Clínica para el tratamiento de la COVID-19 en México. Consenso de personas expertas del sector salud. Febrero2022. Disponible en https://coronavirus.gob.mx/wp-content/uploads/2022/02/2022.02.15- GuiaClinicaTx-COVID.pdf
- Painter WP, Sheahan T, Baric R, Holman W, Donovan J, FangL, et al. Reduction in infectious SARS-CoV-2 in treatment study of COVID-19 with Molnupiravir. Conf. Retroviruses Opportu-
nistic Infect. Virtual 2021. - Comunicado de prensa: Merck and Ridgeback’s Molnupiravir, an Oral COVID-19 Antiviral Medicine, Receives First Authorization in the World. Disponible en: https://www.merck.com/news/merck-and-ridgebacks-molnupiravir-an-oral-covid- 19-antiviral-medicine-receives-first-authorization-in-the-world/.
- Owen DR, Allerton CMN, Anderson AS, et al. An oral SARS CoV-2 Mpro inhibitor clinical candidate for the treatment of COVID-19. Science 2021;374:1586-93.
- Hammond J, Leister-Tebbe H, Gardner A, et al. Oral nirmatrelvir for high-risk, nonhospitalized adults with COVID-19. N Engl J Med. 2022; Published online ahead of print.
- Food and Drug Administration. Fact sheet for healthcare providers: emergency use authorization for Paxlovid. 2021. Disponible en: https://www.fda.gov/media/155050/download
- Wang M, Cao R, Zhang L, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res. 2020;30(3):269- 271.
- Remdesivir (Veklury) [package insert]. Food and Drug Administration. 2020. Disponible en: https:// www.accessdata.fda.gov/ drugsatfda_docs/ label/2020/214787Orig1s000lbl. pdf.
- R.L. Gottlieb, C.E. Vaca, R. Paredes, J. Mera, B.J. Webb, G. Perez, et al., Early Remdesivir to prevent progression to severe Covid-19 in outpatients. N Engl J Med 2022; 386:305-315.
- COVID-19 rapid guideline: Managing COVID-19 – The National Institute for Health and Care Excellence (NICE). 21.1 Publicada el 03.03.2022. Disponible en: https://www.nice.org.uk/guidance/ng191/resources/covid19-rapid-guideline- managing-covid19-pdf-51035553326.