Velasco-Penagos Juan Carlos1, Cano Díaz Ana Luz2.
- Departamento de Infectología, Hospital General de Zona No. 2 IMSS; Tuxtla Gutiérrez, Chiapas. [email protected] ORCID ID: 0000-0002-6079-1209.
- Departamento de Infectología, Hospital de Infectología “Dr. Daniel Méndez Hernández” CMN La Raza IMSS; Ciudad de México. [email protected] ORCID ID: 0000-0001-9659-746X
El dengue es una una arbovirosis (virus transmitidos por artrópodos) y es una de las enfermedades tropicales desatendidas más importantes del mundo1, su incidencia ha aumentado más de 30 veces en las últimas décadas junto con la expansión geográfica del vector, el mosquito del género Aedes, incluye a las especies Aegypti, albopictus y polynesiensiss2.
La transmisión se produce en las regiones tropicales (entre los 35° norte y 35° de latitud sur), mediterráneo oriental, América, Asia sudoriental, Pacífico occidental y África, con nuevos casos que se producen y se propagan a zonas no endémicas en los Estados Unidos y Europa.
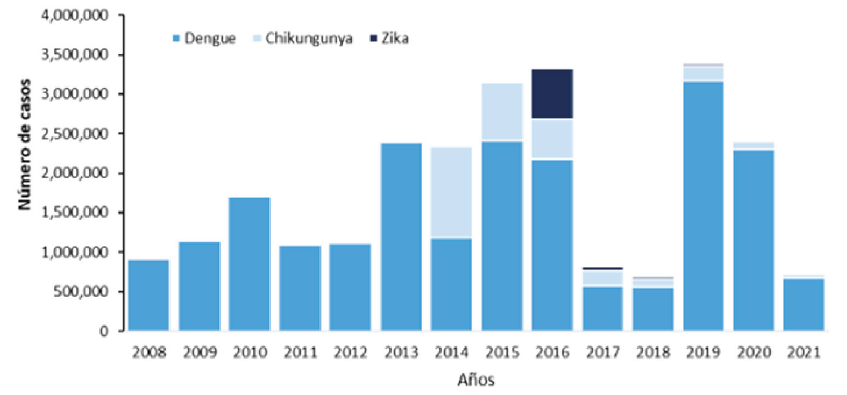
Figura 1. Distribución de casos de Dengue, Chikungunya y Zika por año de notificación. Región de las Américas, 2008-2021 (Hasta la semana epidemiológica 22 del 20214
Entre el 1 de enero y el 11 de diciembre de 2023 se notificaron 4,1 millones de presuntos casos de dengue (con una incidencia acumulada de 419 casos por cada 100 000 habitantes), entre ellos 6710 casos graves (el 0,16% de los presuntos casos) y 2049 muertes (tasa de letalidad del 0,05%) en 42 países y territorios de la Región de las Américas, y 15 países notificaron un brote activo. Del total de casos de dengue registrados hasta el 12 de noviembre de 2023 (la semana epidemiológica 48 de 2023), 1,895,122 (el 45%) fueron confirmados en laboratorios 3,4
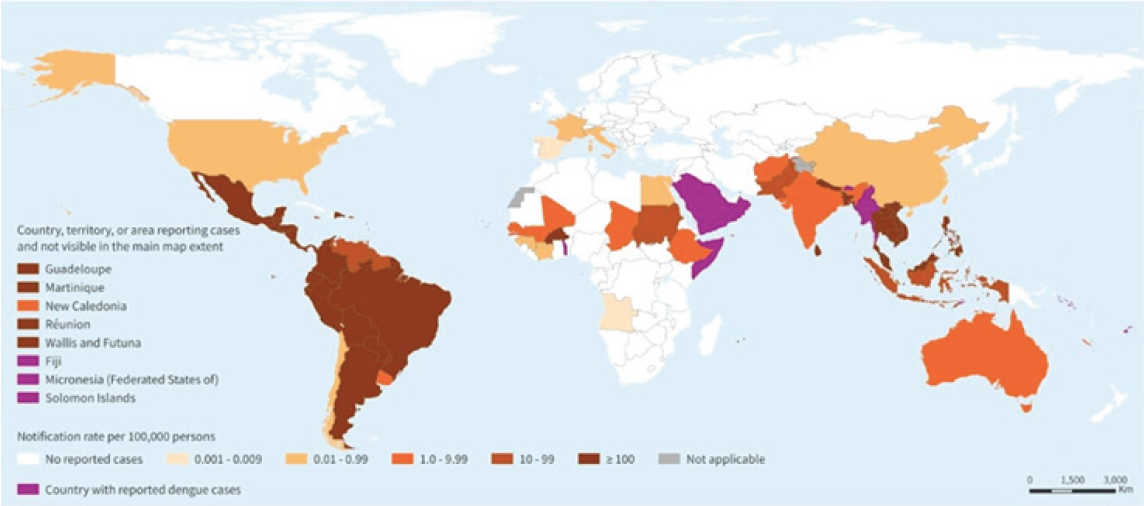
Figura 2. Países, territorios y áreas que notifican casos autóctonos de dengue
(de noviembre de 2022 a noviembre de 2023) 5
Etiología
El virus del dengue (DENV, acrónimo oficial) pertenece a la familia Flaviviridae, del género flavivirus, es un virus RNA monocatenario en sentido positivo (Baltimore IV).
Existen cuatro serotipos denominados DENV1 a DENV4. Los cuatro serotipos circulan periódicamente en áreas endémicas e hiperendémicas y todos causan la enfermedad conocida como dengue6. El genoma del virus del dengue mide 11 kb, tiene un extremo 5´corto no codificante, enmedio un marco de lectura abierto largo y un extremo 3´ no codificante de longitud variable; tres proteínas estructurales: la proteína de membrana (M), la proteína envolvente (E) y la proteína cápside (C) (esto en un virus maduro, ya que cuando es un virus inmaduro la proteína M es sustituida por el precursor de la proteína M [prM]); las proteínas no estructurales (NS) son NS1, NS2A, NS2B, NS3, NS4A, NS4B y NS57 intervienen durante los procesos de ensamblaje y replicación del RNA genómico, entre otras, a diferencia de otros flavivirus, la maduración del virión se lleva a cabo tanto en el retículo endoplásmico como en el aparato de Golgi.
El ciclo viral cursa con fases de unión y adhesión viral, fusión y desnudamiento, traducción y procesamiento de la poliproteína viral, maduración en el reticulo endoplásmico, maduración en el aparato de Golgi y liberación de la nueva particula viral.
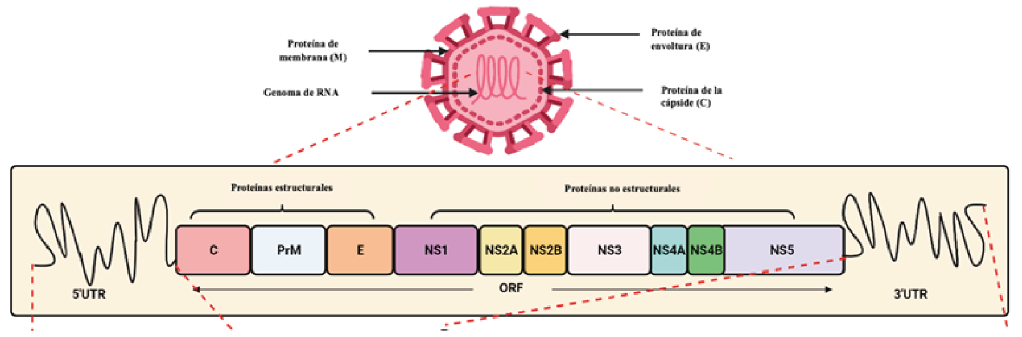
Figura 3. Organización estructural del virus del dengue y su genoma. Región cinco prima no codificante (5´UTR); región 3 prima no condificante (3´UTR); marco de lectura abieto (ORF); precursor de proteína M (PrM). Adaptado de Nanaware N, viruses 2021.
Patogenia
El mosquito hembra se infecta cuando pica a un huésped virémico, a partir de este momento se da el período de incubación extrínseca (replicación del virus dentro del mosquito), infecta primero las células del intestino y luego las glándulas salivales entre 5-12 días después; ya en las glándulas salivales el mosquito es infeccioso y transmite el virus a otra persona durante su siguiente ciclo de alimentación9 . El mosquito permanece infeccioso de por vida y puede infectar a cada persona de la cual posteriormente se alimenta, además tienen la capacidad de transmitir el virus de manera vertical. El tiempo desde la infección hasta el inicio de la enfermedad en los seres humanos (incubación intrínseca) es de 3-14 días, con un promedio de 4-7 días.
En los humanos las células dendríticas dérmicas son inoculadas por el virus, se propaga a los ganglios linfáticos con diseminación hematógena, la replicación viral ocurre en macrófagos, células de Kupffer hepáticas, endotelio, células tubulares renales y macrófagos alveolares. De hecho al momento de inicio de síntomas casi todos pacientes se encuentran viremicos, y ésta se elimina días posteriores a la defervescencia.
Hasta ahora se cree que la gravedad puede depender del serotipo:
- Los serotipos tipos 2 y 3, parecen estar asociados con choque y hemorragia.
- Los serotipos 1 y 4 parecen estar asociados con una enfermedad más leve.
La respuesta inmunológica humoral es a través de la producción de anticuerpos neutralizantes contra las proteínas E, pre-M y NS. 4 La infección primaria induce inmunidad de por vida al serotipo infeccioso y cierta inmunidad cruzada (por poco tiempo) a otros serotipos, debido a que la proteína NS1 se expresa en la superficie de las células infectadas y también funciona como antígeno fijador de complemento; los anticuerpos contra NS1 no neutralizan el virus, ya que los anticuerpos “heterológos” de una infección previa aumentan la captación y replicación virales de células con receptores Fc, a esto se le conoce como efecto Hoskins.
Manifestaciones clínicas
- Fase febril: primeros 2 a 7 días, acompañada de escalofríos, malestar general, anorexia, erupción cutánea, mialgias, artralgias, cefalea, dolor abdominal, letargo, y/o evidencia de sangrados a diferentes niveles. Puede cursar con 2 períodos febriles, un patrón llamado en silla de montar.
- Fase crítica: ocure en el día 3 a 7 de la enfermedad, la fiebre va de 37.5 a 38ºC, la duración de esta fase es de 24 a 48 horas, en esta etapa puede existir mayor compromiso hemodinámico,incluye: disnea, alteración del estado neurológico, estado de choque, debido a la permeabilidad y fuga plasmática.
- Fase de recuperación: ocurre una vez que se resuelve la fase crítica, se caracteriza por la reabsorción de líquido extravascular, resolución de síntomas en 1 a 2 semanas.
Diagnóstico
Se debe considerar la clínica y el antecedente epidemiólogico de visita a zonas endémicas, establecer el tiempo desde la posible exposición y la fase del cuadro clínico en la que se encuentra el paciente.
Existen diferentes pruebas para el diagnóstico de la enfermedad con rendimiento diagnóstico variable dependiendo de la fase en la que se encuentra la enfermedad.
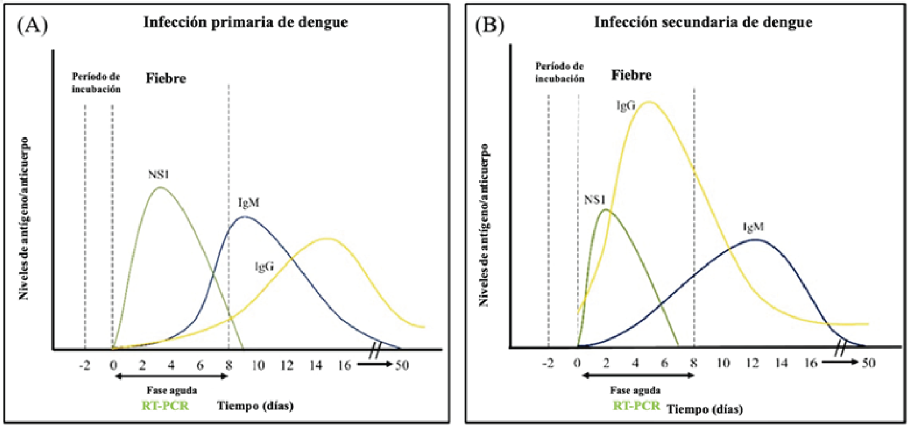
Figura 4.RNA detectable (RT-PCR), antígeno no estructural 1 (NS1) y anticuerpos (IgG e IgM) de acuerdo con la evolución la infección. Adaptado de Kok BH, 2022
Pruebas diagnósticas disponibles:
RT-PCR: positivo del día 0 al día 7.
Cultivo de virus: poco rentable, difícil de realizar pues se requieren células de Ae. albopictus y RT-PCR.
Prueba NS1: positivo del día 0 al día 7.
Detección de anticuerpos mediante ELISA:
IgM: detectabe al día 5 del inicio de la enfermedad hasta día 20 (algunas veces hasta 90 días).
IgG: detectable a los 2 semanas y permanece de por vida, no útill para diagnóstico.
Mediante hemaglutinación es poco sensible y específico.
Clasificasión según la OMS5:
- Probable dengue sin signos de alarma: residencia o viaje a una zona endémica + fiebre (típicamente 4 a 10 días después de la exposición) y, ≥ 2 de los siguientes: náuseas o vómitos, erupción, prueba de torniquete positiva, leucopenia.
- Probable dengue con datos de alarma: igual que el anterior + 1 de los siguientes: dolor o sensibilidad abdominal, vómitos persistentes, edema, sangrado de mucosas, letargo, hepatomegalia > 2 cm, aumento del hematocrito con disminución de recuento de plaquetario.
- Dengue grave (puede desarrollarse incluso sin signos de alarma): pérdida importante de plasma que conduce a choque o acumulación de líquido con dificultad respiratoria, sangrado grave, deterioro multiorgánico, elevación de enzimas hepáticas: alanina aminotransferasa o aspartato aminotransferasa ≥ 1000 UI/L, conciencia alterada.
- Dengue confirmado: cultivo viral positivo para el virus del dengue, seroconversión de IgM en sueros pareados (1 durante la infección aguda y 1 después de la recuperación), seroconversión de IgG o aumento de 4 veces el título de IgG en sueros pareados, prueba positiva del antígeno del dengue (NS1), positividad de PCR para el ARN del virus del dengue.
Tratamiento
No existe un tratamiento específico para el dengue, únicamente hidratación y manejo sintomático; de acuerdo a la severidad se valorará la necesidad de hospitalización. Se debe brindar manejo del dolor y fiebre con paracetamol (en caso de no haber contraindicación), los analgesicos antiinflamatorios no esteroideos (AINES) y el ácido acetilsalicilico están contraindicados. Los esteroides o antibióticos no ha mostrado beneficio. La OMS/OPS clasifica el dengue en 4 categorías para el tratamiento:13-15,1
Categoría A:
- Reposo en cama.
- Uso estricto de mosquitero durante la fase febril.
- Ingesta de líquidos adecuada adultos: cinco vasos de 250 ml o más por día.
- Paracetamol adultos: 500 mg/dosis cada 6 horas; dosis máxima diaria: 4 g.
- Pacientes con hematocrito estable pueden continuar su atención en el hogar.
Categoría B1:
- Hidratación vía oral. En caso de intolerancia a la vía oral, iniciar tratamiento intravenoso con ringer lactato ó solución salina (0,9%) a dosis de mantenimiento a 2-4 ml/kg/hora; reiniciar vía oral lo antes posible.
- Tratamiento sintomático igual al Grupo A
Categoría B2:
- Administrar ringer lactato ó Hartmann ó solución salina 0,9%: 10 ml/kg en 1 h.
- Reevaluar: si datos de alarma y diuresis (1 ml/kg/h), repetir carga con cristaloide isotónico 1 o 2 veces más.
- Reevaluar: si hay mejoría clínica y diuresis es ≥ de 1 ml/kg/h, reducir el goteo a 5-7 ml/kg/h y continuar por 2 a 4 h; si continúa la mejoría clínica, reducir a 3-5 ml/kg/h por 2 a 4 h. Luego continuar el goteo a razón de 2-4 ml/kg/h por 2 a 4 horas según las necesidades del paciente.
- Reevaluar el estado clínico del paciente: repetir el hematocrito, si continúa igual o tiene un aumento mínimo, continuar el goteo a razón de 2-4 ml/kg/h por 2 a 4 h más.
- Si hay deterioro de signos vitales o incremento rápido del hematocrito: tratar como grupo C y referir al siguiente nivel de atención.
- Reevaluar el estado clínico del paciente, repetir el hematocrito y modificar la velocidad de infusión de líquidos.
- Reducir gradualmente la velocidad de los líquidos cuando el volumen de fuga de plasma disminuya o haya finalizado la fase crítica.
Categoría C:
- Obtener un hematocrito antes de hidratar al paciente; el no disponer de hematocrito no debe retrasar el inicio de la hidratación.
- ABC + monitoreo de signos vitales cada 5 a 30 minutos
- Oxigenoterapia
- Iniciar hidratación intravenosa con cristaloide a 20 ml/kg en 15 a 30 min.
- Si desaparecen los signos de choque disminuir el volumen de líquido a 10 ml/kg/h; continuar por 1 a 2 h. Repetir el hematocrito.
- Si la evolución es satisfactoria, disminuir el goteo a razón de 5-7 ml/kg/h, por 4 a 6 h; continuar a razón de 3-5 ml/kg/h por 2 a 4 h, luego mantener a 2-4 ml/kg/h, por 24 a 48h.
- En caso de no presentar mejoría deberá repetir paso 4 y 6 hasta alcanzar mejoría.
- Tratamiento de la hemorragia: glóbulos rojos 5-10 ml/kg o sangre fresca a 10-20 ml/kg
- Si el paciente no mejora evaluar nuevamente la situación hemodinámica.
- Evaluar la función cardíaca y si es necesario el uso de aminas.
- Evaluar las condiciones médicas concomitantes y estabilizar la afección de base.
- Valorar la acidosis
Prevención
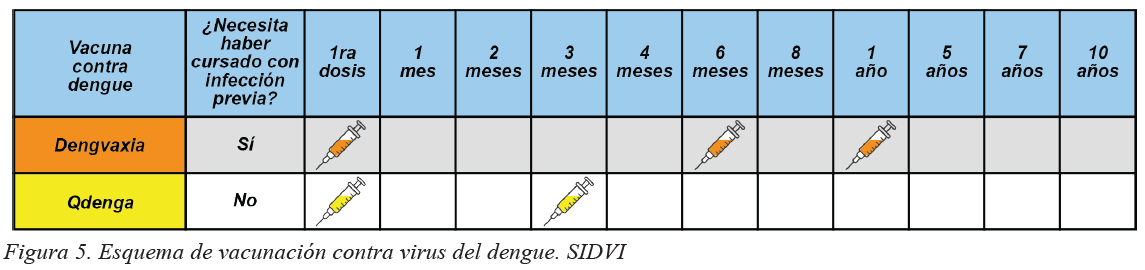
(CYD-TDV) y Qdenga® (TAK 003).
Dengvaxia® (Sanofi Pasteur): vacuna tetravalente que protege contra los 4 serotipos de DENV, con una eficacia promedio de 60% de protección contra la enfermedad, mayor contra los serotipos DENV-3 (74%) y DENV-4 (77%), y menor para DENV-1 (50.3%) y DENV-2 (42.3%).18 No está recomendada en personas que no han estado expuestasal virus del dengue ya que aumenta el riesgo de enfermedad severa, por lo que es indispensable determinar la memoria inmunológica mediante pruebas serológicas.
Qdenga®/TAK 003 (Takeda), es una vacuna que protege contra los cuatro serotipos de DENV, eficacia general de 62% y una eficacia contra hospitalización por dengue de 83.6%, independientemente del estado serológico (protege tanto a individuos que no han sido infectados con DENV como a aquellos que han presentado infección previa). La eficacia contra los serotipos es variable: 56.2% para DENV-1, 52.3% para DENV-2, 52.3% para DENV-3 y 60.7% para DENV-4.19
Control del vector:
- Alojamientos con ventanas y puertas bien protegidas, cerradas, que cuenten con aire acondicionado, cuando sea posible.
- Use ropa que cubra los brazos y las piernas (especialmente temprano en la mañana y al final de la tarde, pues kel riesgo de ser picado es mayor).
- Utilice repelente de insectos.
- Vacíar, limpiar, o cubrir cualquier agua estancada.
Referencias
- Guzman, M. G. & Harris, E. Dengue. Lancet 385, 453–465 (2015).
- Baldi MG, Hernández RS, Gómez LR. Actualización de la fiebre del Dengue. Revista Médica Sinergia. 2020;5(01):341.
- Milby, K. M., Atallah, A. N., Rocha-Filho, C. R., Pinto, A., Rocha, A., Reis, F., Carvas Junior, N., Civile, V. T., Santos, R., Ferla, L. J., Trevisani, G., Ramalho, G. S., Puga, M., & Trevisani, V. (2020). SARS-CoV-2 and arbovirus infection: a rapid systematic review. Sao Paulo medical journal = Revista paulista de medicina, 138(6), 498–504
- https://www.paho.org/data/index.php/es/
- https://www.who.int/es/emergencies/disease-outbreak-news/item/2023-DON498
- Lindenbach B, Thiel H, Rice C. Flavivirus: The virus and their replication. In: Knipe D, Howley Peter. Fields Virology. Philadelphia: Lippincott Williams & Wilkins; 2007. p. 1101-52.
- Modis, Y., Ogata, S., Clements, D. & Harrison, S. C. A ligand-binding pocket in the dengue virus envelope glycoprotein. Proc. Natl Acad. Sci. USA 100, 6986–6991 (2003)
- Velandia M. et al. Virus del dengue: estructura y ciclo viral. Infectio. 2011
- Gubler, D. J. in Dengue and Dengue Hemorrhagic Fever 2nd edn (eds Gubler, D. J., Ooi, E. E., Vasudevan, S. & Farrar, J.) 1–29 (CAB International, 2014)
- Siler, J. F., Hall, M. W. & Hitchens, A. P. Dengue: its history, epidemiology, mechanism of transmission, etiology, clinical manifestations, inmunity and prevention. Philippine J. Sci. 29, 1–304 (1926).
- Guzman M, Gluber D, et al. Dengue infection. Nature Reviews Diseade Primers, 2016, Volumen 2
- Tang, K. F. & Ooi, E. E. Diagnosis of dengue: an update. Expert Rev. Anti Infect. Ther. 10, 895–907 (2012).
- Toledo, J. et al. Relevance of non-communicable comorbidities for the development of the severe forms of dengue: a systematic literature review. PLoS Negl. Trop. Dis. 10, e0004284 (2016)
- Harris, E. et al. Fluid intake and decreased risk for hospitalization for dengue fever, Nicaragua. Emerg. Infect. Dis. 9, 1003–1006 (2003).
- https://www.who.int/news-room/fact-sheets/detail/dengue-and-severe-dengue
- https://www.cdc.gov/dengue/es/index.html
- Dengue: guías para la atención de enfermos en la Región de las Américas. 2.ed. Washington, DC: OPS, 2016
- Hadinegoro S. et al. Efficacy and Long-Term Safety of a Dengue Vaccine in Regions of Endemic Disease. N Engl J Med 2015;373:1195-206.
- Biswal S. et al. Efficacy of a Tetravalent Dengue Vaccine in Healthy Children and Adolescents. N Engl J Med 2019; 381:2009-2019
- Kok BH, Lim HT, Lim CP, Lai NS, Leow CY, Leow CH. Dengue virus infection – a review of pathogenesis, vaccines, diagnosis and therapy. http://dx.doi.org/10.1016/j.virusres.2022.199018
- Nanaware N, Banerjee A, Mullick Bagchi S, Bagchi P, Mukherjee A. Dengue virus infection: A tale of viral exploitations and host responses. Viruses, 2021;13(10):1967. Disponible en: http://dx.doi.org/10.3390/v1310196