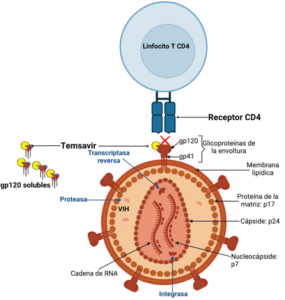
Después de la aparición del VIH/SIDA, científicos preocupados por la aparición de esta nueva enfermedad, crearon la IAS (International AIDS Society) con el objetivo de reunir a expertos de todo el mundo y diversas disciplinas para promover una respuesta concertada hacia el VIH. La IAS alberga las conferencias sobre el VIH más importantes del mundo: la Conferencia Internacional sobre el SIDA (AIDS Conference), la conferencia sobre la ciencia del VIH de la IAS y la Conferencia sobre Investigación para la Prevención del VIH. En este año se realizó AIDS 2022 en Montreal, Canadá. Presentamos algunos datos relevantes de este congreso internacional.
PrEP con fármacos inyectables (HPTN-083)
HPTN 083, es un ensayo de fase IIb/III, aleatorizado, doble ciego, el cual demostró superioridad de CAB Long-acting (LA) inyectable vs TDF/FTC oral diario en PrEP para VIH en hombres que tienen sexo con hombres (HSH) cisgénero y mujeres transgénero (MTG). La incidencia de VIH por 100 pacientes al año (PA) fue 0.41 para CAB LA vs 1.22 para TDF/FTC (HR: 0.34; 95% CI: 0.18-0.62).
Las MTG son un grupo prioritario para la prevención de VIH y han sido sub-representadas en los ensayos clínicos. En el estudio actual Grinsztejn et al., reportan la seguridad, eficacia en la prevención y farmacocinética de CAB LA inyectable en MTG durante la fase cegada del HPTN 083.
Las características de pacientes incluyeron historial de violen-cia interpersonal, percepción de riesgo de VIH y uso de terapia hormonal comparados entre MTG y HSH cisgénero. Se midieron los EAs grado ≥2 e incidencia de VIH e ITS durante la fase cegada, en MTG aleatorizadas a CAB vs TDF/FTC.
Se compararon las concentraciones de CAB en los subgrupos de MTG que recibieron todas las inyecciones en tiempo hasta la semana 59, con y sin terapia hormonal de sustitución.
Se encontró que la incidencia en MTG fue 1.8% (TDF/FTC) y 0.54% (CAB-LA) durante la fase cegada (hazard ratio: 0.34, 95%, CI 0.08-1.56). Cuando se comparó con toda la cohorte de HPTN 083, las MTG experimentaron un incremento en la frecuencia de violencia sexual (56.7% vs. 45.4%), física (30.2% vs. 19.2%) y emocional (47.4% vs. 36.4%) y una autopercepción más baja del riesgo de adquirir VIH (53.3% vs. 66.5%). CAB-LA fue bien tolerado en MTG; la frecuencia de eventos adversos grado 2+ no difirió entre las MTG que recibieron CAB-LA o TDF/FTC (92.5% vs. 88.8%).
Las concentraciones de CAB fueron similares entre MTG que recibían terapia de sustitución hormonal y MTG que no la recibían, lo que sugiere que la terapia hormonal no afecta la farmacocinética de CAB. Los autores concluyen que CAB LA inyectable es seguro y efectivo para prevenir VIH en MTG. Se demostró una menor incidencia de infecciones por VIH con CAB LA vs TDF/FTC durante una mediana de seguimiento de 1.4 años en MTG y la incidencia de EAs grado ≥2 y EAs grado ≥3 en MTG fueron similares entre los brazos de estudio.
Se determina que la terapia de sustitución hormonal no afectó las concentraciones de CAB LA en este análisis preliminar.
PrEP con fármacos inyectables (HPTN-084)
HPTN 084 es un ensayo de fase III, aleatorizado, de CAB LA inyectable en mujeres cisgénero con alto riesgo de infección por VIH.
La eficacia y seguridad fueron previamente reportadas en un periodo del estudio cegado, CAB LA inyectable mostró superioridad vs TDF/FTC diario oral para la prevención de VIH. La incidencia de VIH: 0.20 por 100 PA con CAB vs 1.85 por 100 PA con TDF/FTC (HR: 0.12; 95% IC: 0.05-0.31; P <0.001).
El objetivo del análisis actual por Delany-Moretlwe et al., fue evaluar la eficacia y seguridad de un año de seguimiento adicional durante un periodo no cegado que inició en noviembre de 2020 posterior al análisis interino. Los participantes continuaron en el régimen asignado originalmente después de quitar el cegamiento, mientras esperaban la fase abierta del protocolo de CAB. La incidencia acumulada de VIH incluyó la fase cegada y la no cegada de 12 meses.
Se encontraron 23 infecciones incidentes (3 CAB y 20 TDF/FTC) en el periodo de 12 meses no cegado. De éstas, dos (1CAB y 1 TDF/FTC) se determinó su ocurrencia durante la fase cegada.
Hubo una reducción en la incidencia de VIH en 89% con CAB vs TDF/FTC. El perfil de seguridad fue consistente con datos previos; no se observaron nuevos EAs. Se confirmaron 83 embarazos (43 CAB, 40 TDF/FTC), sin anormalidades congénitas reportadas. Los autores concluyen que se mantiene la superioridad de CAB (HR 0.11, 95% IC 0.05-0.24).
Estudio DoxyPEP
Las tasas de infecciones de transmisión sexual (ITS) son desproporcionadamente altas en hombres que tienen sexo con hombres (HSH). La PEP intermitente con doxiciclina ha mostrado disminuir la presencia de episodios iniciales de ITS bacterianas en HSH.
Luetkemeyer et al., diseñaron el estudio DoxyPEP, un ensayo clínico controlado abierto para evaluar la eficacia de doxiciclina en PEP como prevención de ITS en HSH y mujeres transgénero (MTG) que viven con VIH o que reciben PrEP.
Tuvieron la cohorte de pacientes que viven con VIH (PVVIH) que incluyó HSH y MTG; y la cohorte de HSH en PrEP. Ambas se aleatorizaron 2:1 a recibir doxiciclina 200 mg vía oral en las 72 horas posteriores a tener un contacto sexual sin uso de condón.
Su principal variable fue detectar ≥1 ITS incidente (gonorrea, clamidia o sífilis) durante las pruebas de ITS realizadas en forma trimestral.
La reducción de riesgo de ITS en el grupo de PrEP fue 0.34 (0.24-0.46) y en la cohorte de PVVIH fue de 0.38 (0.24-0.60); además se observaron menos síntomas a la detección de ITS. Los autores encuentran que la PEP tomada dentro de las 72 h de sexo sin condón disminuye la incidencia de ITS en HSH y MTG. Hubo una reducción del 62% en la cohorte de PVVIH y 66% en la cohorte de PrEP por trimestre. La incidencia de gonorrea, clamidia y sífilis también disminuye sustancialmente. La PEP con doxiciclina fue bien tolerada, se asoció con buena adherencia (por auto-reporte) y pocas suspensiones.
Los investigadores concluyen que la PEP con doxiciclina proporciona una prevención confiable contra ITS en poblaciones donde la incidencia de ITS es alta, aunque se necesita mantener la vigilancia de la resistencia a tetraciclinas en gonorrea y en organismos tales como Staphylococcus aureus, Neisseria comensal y el microbioma intestinal.
Tratamiento de la infección por VIH (Estudio NAMSAL)
En las guías de la Organización Mundial de la Salud (OMS) del 2015, DTG 50 mg + 3TC/TDF y dosis bajas de EFV (400 mg) + 3TC/TDF estaban como regímenes alternativos debido a uso limitado fuera de los ensayos clínicos y seguridad desconocida en embarazo y en PVVIH coinfectados con tuberculosis en tra-
tamiento con rifampicina.
El objetivo de NAMSAL fue comparar estos 2 regímenes en condiciones de la vida real en países con medianos y bajos ingresos. Los resultados a la semana 48 y 96 demostraron no-inferioridad de DTG vs. dosis bajas de EFV, lo que llevó a la OMS recomendar regímenes con DTG como TAR de primera línea preferente y a regímenes con dosis bajas de EFV (400 mg) como alternativos en el año 2019.
El análisis actual presentado por Mpoudi-Etame et al., evalúa la seguridad y eficacia en la semana 192 de regímenes con DTG 50 mg + 3TC/TDF y EFV 400 mg + 3TC/TDF.
A la semana 192, la proporción de participantes con carga viral (CV) <50 copias/mL en el análisis por ITT fue 69% para DTG (214/310) y 62% para EFV (187/303) (diferencia, 7.3%; IC-95%, [−0.20;14.83], p=0.057, en el análisis por protocolo 75% (DTG: 172/230) y 66% (EFV400: 178/271) respectivamente (diferencia, 9.1%; IC-95%, [1.13;17.07], p=0.027). Durante los cuatro años, la ganancia de peso fue mayor con DTG que con EFV: (Mujeres (F): DTG +8.0 Kg, EFV400 +5.0 Kg, p=0.010; Hombres (H): DTG +6.0 Kg, EFV400 +4.0 kg; p=0.024); incidencia de obesidad (F: DTG 17%, EFV400 11%, p=0.140; H: DTG 26%, EFV400 4%; p<0.001); la proporción de pacientes que tuvieron una ganancia de peso de al menos 15% comparado con su peso inicial (F: DTG 43%, EFV400 31%, p=0.030; H: DTG 23%, EFV400 25%; p=0.848. Los autores concluyen que tanto DTG + 3TC/TDF y dosis bajas (400 mg) de EFV + 3TC/TDF son efectivos y seguros para el tratamiento de PVVIH naïve a TAR; se tuvieron tasas más altas de supresión virológica con DTG vs EFV durante este tiempo, particularmente en aquellos con CV basal alta. La supresión virológica fue menos duradera para pacientes con CV basal >100,000 copias/mL con EFV y finalmente la ganancia de peso fue significativamente mayor con DTG + 3TC/TDF vs EFV (400 mg) + 3TC/TDF, particularmente en mujeres.
Tratamiento de la infección por VIH con esquemas de biterapia (Estudio SIMPL’VIH)
La TAR con 2 fármacos ayuda a abordar los desafíos asociados con una combinación de TAR estándar para PVVIH. Actualmente se encuentra respaldada como TAR inicial, así como en cambio para pacientes con supresión virológica en el régimen actual, por lineamientos EACS y de USA.
Los resultados de SIMPL’HIV a la semana 48 mostraron no-inferioridad del cambio de una combinación estándar con TAR para DTG + FTC vs continuar la TAR estándar en PVVIH virológicamente suprimidos. La carga viral RNA VIH-1 <50 copias/mL (FDA snapshot) a semana 48 alcanzó 91%. El reporte actual por Marinosci et al., describe los resultados de eficacia de SIMPL’HIV a 144 semanas. En este estudio 93 participantes fueron aleatorizados a DTG+FTC y 94 a TAR combinada (TARc). A la semana 144, la carga viral RNA VIH-1 >50 copias/mL se observó en un paciente en el grupo DTG + FTC y en cuatro pacientes en el grupo de TAR combinada (diferencia ajustada −3.2%; 95%-IC −7.7-1.5%). La ganancia media de CD4+ del basal a semana 144 fue 8.4 (±195.3) y 34.7 (±193.6) células/mm3 con DTG+FTC y TARc respectivamente
(diferencia ajustada −19.4; 95% IC −74.2-35.4). Doce (12.9%) con DTG + FTC y 15 (18.1%) en el grupo de TARc presentaron EAs serios a semana 144. La ganancia de peso basal a la semana 144 fue 2.4 (±4.7) vs 2.3 (±4.1) kg con DTG+FTC y TARc respectivamente. Los participantes con ganancia de peso de 10% o más, fueron 7.5% y 6.4% en el grupo DTG + FTC y TARc respectivamente.
Los autores concluyen que el cambio de una combinación estándar de TAR a DTG + FTC fue no-inferior a continuar TAR combinada estándar en adultos virológicamente suprimidos a la semana 144. La calidad de vida fue similar en ambos grupos.
El cambio en el peso comparado del basal, no fue clínicamente significativo. En cuanto a la seguridad, no se observaron nuevos EAs que se hayan observado a la semana 144 y las tasas de éstos fueron similares en ambos grupos.
Tratamiento de la infección por VIH con esquemas de biterapia (Estudio ANDES)
La TAR con 3 fármacos ha sido la terapia estándar para el manejo de VIH por décadas. La TAR doble con INSTI ha emergido como TAR inicial efectiva para muchos pacientes y ahora está como una opción recomendada. Un régimen con DRV/RTV + 3TC demostró eficacia no inferior vs terapia triple como una estrategia de cambio para pacientes con supresión virológica bajo terapia ARV en el estudio DUAL-GESIDA 8014-RIS-EST45. DRV/RTV 800 mg/100 mg está disponible como una dosis fija combinada (FDC) genérica en países como Argentina.
En este estudio ANDES, Figueroa et al., evaluaron la seguridad y eficacia de FDC DRV/RTV tanto con 3TC o 3TC/TDF en PVVIH naïve a tratamiento.
De 395 pacientes evaluados, 336 fueron aleatorizados a recibir terapia dual (TD) (n:171) o terapia triple (TT) (n:165). Las características basales de los pacientes fueron similares en los 2 grupos. A la semana 48, 92.7% en TT vs 90.6% en TD tuvieron CV <50 copias/mL, diferencia (95%IC): −2.1%(-7.0; 2.9%). Los pacientes con CV basal >100,000 copias/mL mostraron respuesta en 90.3% de los pacientes en TT vs 86.7% en TD, diferencia (95%IC):-3.7% (-15.7;8.4%). La mediana del cambio de CD4+ del basal fue +238.1 células/uL en TT, vs +275.3 células/uL en TD (p:0.4). Los eventos adversos fueron similares en ambos grupos, excepto para diarrea (TT: 5%; TD: 1%; p:0.06**) y dolor abdominal (TT: 5%; TD: 1%; p:0.03). Los hallazgos de laboratorio fueron similares excepto para mayor incremento en el colesterol total en el brazo de la TD (TT:8%;T-D:20%;p<0.01), LDL-colesterol (TT:8%;TD:19%;p:0.01) y triglicéridos (TT:38%;TD:56%;p=0.05). Los autores concluyen que el inicio de la TAR con FDC DRV/RTV + 3TC fue no-inferior a FDC DRV/RTV + 3TC/TDF a las 48 semanas en pacientes naïve a TAR. La carga viral RNA VIH-1 <50 copias/mL: 91% vs 93% (diferencia -2.1%; 95% IC: -7.0 a 2.9; P <.01). El margen de no-inferioridad no se encontró entre los grupos para pacientes con RNA VIH-1 basal >100,000 copias/mL (n = 76), la carga viral RNA VIH-1 <50 copias/mL: 87% vs 90% (diferencia -3.7%; 95% IC: -15.7 a 8.4; P = 0.13). Hubo pocas fallas virológicas en ambos brazos y la terapia dual fue bien tolerada.
Paciente con infección por VIH y Coinfección con VHB (Estudio ALLIANCE)
proximadamente 8% de las PVVIH están coinfectadas con VHB. Hay tasas de hasta 25% en áreas donde ambos virus son endémicos. La morbilidad y mortalidad empeora con la coinfección VIH/VHB vs mono infección por VHB. Los pacientes coinfectados tienen niveles más altos de DNA VHB y mayor riesgo de cirrosis hepática y cáncer.
Los regímenes de ARVs con TDF o TAF más 3TC o FTC son el backbone de NRTI recomendados por las guías internacionales para la mayoría de las personas con VIH/VHB con el objetivo de suprimir ambos virus. No hay estudios aleatorizados de TDF vs. TAF en adultos con coinfección VIH/VHB para iniciar
tratamiento.
En este estudio, Avihingsanon et al., comparan B/F/TAF vs DTG + TDF/FTC en personas naïve a tratamiento con coinfección con VIH y VHB.
Se incluyeron 243 participantes aleatorizados y tratados (121 B/F/TAF, 122 DTG+TDF/FTC). Las características basales fueron similares entre los dos grupos. A la semana 48, B/F/TAF fue no-inferior a DTG+F/TDF para alcanzar CV RNA VIH-1 <50 copias/mL (95% vs 91%, diferencia 4.1%; 95% IC -2.5% a 10.8%, p=0.21), con media de ganancia de CD4+ de +200 y +175 células/mm3 respectivamente. B/F/TAF fue superior a DTG+TDF/FTC para efectuar CV DNA VHB <29 IU/mL (63% vs 43%, diferencia 16.6%; 95% IC 5.9% a 27.3%, p=0.0023). Los participantes tratados con B/F/TAF vs DTG+T-DF/FTC tuvieron pérdida del HBsAg (13%, 6%, p=0.059), pérdida de HBeAg (26%, 14%, p=0.055), seroconversión del HBeAg (23%, 11%, p=0.031), y normalización de ALT (73%, 55%, p=0.066).
Los autores concluyen que a 48 semanas de tratamiento con B/F/TAF es efectivo para personas con coinfección por VIH/VHB. No inferioridad de B/F/TAF vs DTG + TDF/FTC (95% vs 91%) con respecto a RNA VIH-1 <50 copias/mL. Superior B/F/TAF a DTG + TDF/FTC (63% vs 43%) con respecto a DNA VHB <29 UI/mL. Los hallazgos de seguridad fueron comparables entre los brazos de estudio. No hubo casos de resistencia emergente a fármacos para VIH. Se presentaron pocos EAs o suspensiones asociadas a los fármacos en estudio.
Paciente con infección por VIH y Coinfección con Tuberculosis (Estudio TB-PRACTECAL)
En forma global, hay 862,000 nuevos casos de TB en PVVIH en 2018; 477,461 se notificaron. Se estiman al año 465,000 casos de TB resistente a rifampicina.
TB-PRACTECAL evalúa la seguridad y eficacia de tres regímenes orales a 24-semanas para el tratamiento de TB pulmonar resistente a rifampicina en 7 sitios de Uzbekistán, Bielorrusia, y Sudáfrica.
El reporte actual por Motta et al., presenta eficacia y seguridad de TB-PRACTECAL en PVVIH.
Un total de 552 pacientes fueron incluidos, de los cuales, 153 fueron positivos a VIH, su mediana de CD4+ basal fue 330, 297, 326 y 250 células/μL en BpaLM (BPaLM, bedaquiline, pretomanid, linezolid, moxifloxacin), BPaLC (bedaquiline, pretomanid, linezolid, clofazimine), BPaL (bedaquiline, pretomanid, linezolid) y brazo control respectivamente. En el análisis por ITTm, 28.6%, 35.7%, 28.6% y 40% de PVVIH experimentaron un resultado desfavorable a los brazos con BPaLM, BPaLC, BpaL y control respectivamente.
En conclusión, los datos soportan el uso de regímenes de 24 semanas independientemente del estado de VIH. Se observó que los regímenes más cortos pueden ser más eficaces en pacientes negativos a VIH. La seguridad parece ser similar con BPaLM y BPaL, se espera información adicional en los próximos meses.
Reversibilidad de síntomas neuropsiquiátricos con cambio de TAR
Los problemas neuropsiquiátricos se han encontrado con frecuencia en los pacientes que inician terapia antirretroviral (TAR). Rodríguez-Evaristo et al., presentan información relevante de los cambios en los pacientes con eventos neuropsiquiátricos (NPS) y la realización de un cambio de tratamiento a otro esquema antirretroviral.
El objetivo de su estudio fue evaluar la mejoría de eventos adversos NPS después del cambio de un régimen con INSTI a uno con Darunavir/Cobicistat (DRV/c) o Doravirina (DOR).
Diseñaron un ensayo clínico de un brazo en el Hospital de Infectología CMN La Raza en México, de marzo a diciembre de 2021. Se realizaron las escalas Patient Health Questionnaire (PHQ-9) e Insomnia Severity Index (ISI) en pacientes que iniciaron TAR con Dolutegravir (DTG) o Bictegravir (BIC).
Consideraron realizar cambio con puntaje PHQ-9 >15 y/o ISI >15 puntos a esquemas con DRV/c o DOR. Compararon las escalas aplicadas previas al cambio y cuatro semanas después utilizando test de Wilcoxon.
Se incluyeron 339 hombres que iniciaron TAR con esquemas a base de INSTI, 238 (70%) con BIC y 101 (30%) con DTG. De los 339 pacientes analizados, su mediana de edad fue 27 años (IQR 24-31), CD4+ de 258 células/mm3 (IQR 163-362) y carga viral 4.4 log10 (IQR 3.9-4.9); 15 (4.5%) experimentaron eventos adversos neuropsiquiátricos que llevaron a la suspensión del tratamiento, de ellos, 9 (60%) fue depresión moderada-severa o severa, mediana de PHQ-9 de 20 puntos (15-24).
Se detectó insomnio moderado-severo o severo en 9 (60%) de los pacientes, mediana de 22 puntos (IQR 16.5-25.5). Algunos pacientes tuvieron más de un evento adverso NPS que llevó al cambio del tratamiento; 4 (27%) y 11 (73%) se cambiaron a DRV/c y DOR respectivamente. Después de 4 semanas se observó mejoría en PHQ-9, con una mediana de 9 puntos (IQR 5-14), p= 0.003 e ISI de 9 puntos (IQR 4-14), p=0.008.
Los autores concluyen que los eventos adversos neuropsiquiátricos parecen estar asociados a pacientes bajo un régimen con INSTI; éstos pueden mejorar al cambiar a esquemas con DR-V/c o DOR desde las primeras 4 semanas. ISI y PHQ-9 son cuestionarios rápidos y sencillos que se pueden aplicar en cada visita.
La carga viral de VIH y el recuento de CD4+ no están asociados con eventos adversos de las vacuna COVID-19
Se considera que las vacunas COVID-19 aprobadas por las instancias reguladores son seguras para la mayoría de las personas, incluidas las PVVIH. ONUSIDA sugiere que se debe dar prioridad a las PVVIH en las vacunas contra la COVID-19, independientemente del recuento de células CD4+. Pérez-Barragán et al., evalúan la seguridad de las vacunas para la prevención de COVID-19 en PVVIH en un entorno del mundo real.
Realizaron un estudio de casos y controles en PVVIH que asistían a una clínica de VIH en la Ciudad de México y que habían recibido alguna vacuna COVID-19 hasta el 31 de diciembre del 2021. Los casos se definieron como aquellos que informaron al menos un evento adverso de la vacuna (EAV), mientras que los controles no experimentaron ningún EAV. Se aplicó un modelo de regresión logística y se ajustó por edad y comorbilidades para determinar la asociación de experimentar algún EAV según el último recuento de células CD4+ y carga viral RNA VIH-1.
Se incluyeron 253 PVVIH, con una edad media de 37.2 años (±SD 10.8). La mayoría eran hombres 244 (96.4%) y tenían RNA VIH-1 <40 copias/mL [228 (90.1%)] y mediana de CD4+ de 609 células/mm3 (IQR 414-840). Un total de 61 pacientes (24.1%) habían sido diagnosticados con la COVID-19 antes de la vacunación. La frecuencia de EAV fue de 135 (53%), todos ellos leves. No hubo asociaciones con EAV según su carga viral RNA VIH-1 indetectable (1,34, IC del 95 %: 0.57-3.13, p=0.5) o recuento de células CD4+ (OR=0.99, IC del 95 %: 0.97-1.01, p=0.4) .
Este estudio concluye que la carga viral RNA VIH-1 y el recuento de células CD4+ no se asociaron con EAV y se debe promover la vacunación contra la COVID-19 en PVVIH.
Referencias
- Grinsztejn. AIDS 2022. Abstract EPLBC04
- Delany-Moretlwe. AIDS 2022. Abstract OALBX0107
- Luetkemeyer. AIDS 2022. Abstract OALBX0103
- Mpoudi-Etame. AIDS 2022. Abstract OAB0304
- Marinosci. AIDS 2022. Abstract OAB0302
- Figueroa. AIDS 2022. Abstract OAB0303
- Avihingsanon. AIDS 2022. Abstract OALBX0105
- Motta. AIDS 2022. Abstract OAB0402.
- Rodríguez-Evaristo. AIDS 2022. Abstract EPB077
- Pérez-Barragán. AIDS 2022. Abstract EPC480