Banda Lara Marco Isaac1, Reynaga Ortega Cristhian Daniel1, Rangel Frausto Manuel Sigfrido1, Herrera Castillo Cristina de Jesus2, Prudente Isidoro Ramón3
Autor de correspondencia: Marco Isaac Banda Lara GSK México marco.i.banda@gsk.com
En 2021, hubo 38.4 millones de personas viviendo con VIH (Virus de Inmunodeficiencia Humana) a nivel mundial, de los cuales 1.7 millones fueron niños menores de 15 años1, la incidencia de nuevos casos fue de 160,000 en esta misma población.2 Se calcula que actualmente fallece un niño cada cinco minutos por causas asociadas con SIDA (Síndrome de Inmunodeficiencia Adquirida) a nivel mundial, los menores de edad son el 4% de la población total que vive con VIH, pero en esta población se encuentra el 15% de quienes fallecieron en el 2021.
En el 2021 UNAIDS (Joint United Nations Programme on HIV/AIDS) estableció que sólo 52% de los menores de edad con el diagnóstico de VIH recibieron tratamiento, en comparación con el 76% de la población de adultos.3 Se calcula que en México en 2021, el 49% (1,691 niños) se encontraban en tratamiento antirretroviral (135 menos que en 2015); sin embargo, CENSIDA (Centro Nacional de Prevención y Control del VIH/SIDA) en su último reporte del 2022, estableció que para el 20 abril del 2022 se reportaron 2,240 casos activos de menores de edad en tratamiento antirretroviral con un total de 15,907 casos acumulados, donde la mayoría se encuentran entre los 14 a 19 años (en este grupo el 41% son mujeres).
La principal vía de transmisión en menores de 14 años en México continúa siendo la perinatal (99%),7 pero no dejemos de lado el factor social donde a nivel mundial 1 de cada 3 mujeres ha presentado algún tipo de violencia sexual en la vida cotidiana. En México se tuvo el reporte en el 2018 que del 70% de las niñas y adolescentes de entre 10 y 14 años que son madres de un hijo, el padre tenía entre 18 y 78 años. En nuestro país a causa de violencia interpersonal fallecen 5.11% de niñas y adolescentes de 5 a 14 años.
En 2021 en México 5.7 de cada 10 mujeres iniciaron tratamiento antirretroviral durante el embarazo, lo anterior es trascendente, ya que el embarazo es una de las indicaciones de inicio urgente de tratamiento antirretroviral con la finalidad de evitar la transmisión perinatal. Si la atención se realiza en forma oportuna se tiene el 5% de riesgo de paso del virus de VIH al producto en comparación al 15 – 45% de riesgo de transmisión cuando no se realiza ninguna intervención médica.
En los porcentajes de nuevos casos de VIH en mujeres por grupos de edad, durante el 2022 se observó que la mayor cantidad de mujeres mexicanas que viven con VIH se encuentran entre los 15 a 19 años (60%) y de los 20 a 24 años (40%).
Como una respuesta para frenar la transmisión perinatal de VIH, en 2011 el VIH pediátrico fue oficialmente señalado como una enfermedad de olvidados por DNDi (Drugs for Neglected Diseases initiative), organización colaborativa y sin fines de lucro de Investigación y Desarrollo cuya misión es desarrollar nuevos tratamientos para enfermedades “de olvidados” especialmente: leishmaniasis, Chagas, micetoma, etcétera.
LA BRECHA
El principal factor para prevenir la transmisión vertical es el diagnóstico y tratamiento oportuno para la mujer, que como vimos previamente a diferencia de los países desarrollados, la prevención de la transmisión perinatal en nuestro país aún es un logro no alcanzado, de ahí que dentro de las metas de atención de la OMS (Organización Mundial de la Salud) para el 2025 se encuentra que el 95% de las mujeres cuente con acceso a servicios de salud sexual, reproductiva y atención del VIH, y el 95% cuente con cobertura de servicios para la eliminación de la transmisión vertical.11 A diferencia de los adultos, la población pediátrica no ha tenido el mismo desarrollo de los medicamentos antirretrovirales, donde la deglución de tabletas es un reto, así como la dosificación de las fórmulas.
Los lactantes, preescolares y algunos escolares no pueden deglutir tabletas para adultos, aunado a que requieren dosificación especial y la tolerancia a antirretrovirales no es óptima. Algunos medicamentos requieren refrigeración y se debe evaluar las interacciones droga-droga, específicamente con rifampicina en el caso de los niños que presentan coinfección con tuberculosis.
Lo anterior ha condicionado que en población pediátrica se tengan frecuencias más altas que en la población de adultos de mutaciones de resistencia a antirretrovirales, tanto transmitidas como adquiridas. En el 2022 se realizó la publicación de un estudio a este respecto en nuestro país, donde el 22% de los participantes presentó mutaciones de resistencia transmitida y el 75% de los que tuvieron falla a tratamiento presentaron mutaciones adquiridas. Contar con genotipo basal o posterior a falla no siempre es una opción en nuestro contexto.
Si bien los adultos desde hace algún tiempo han sido cambiados a regímenes de inhibidores de integrasa, como resultado de un cambio en las recomendaciones internacionales con base en transmisión de mutaciones transmitidas, simplificación de esquemas y calidad de vida; los niños han tardado más en tener acceso a estos beneficios. La OMS en el 2019 fue la primera en unificar las recomendaciones del tratamiento en todos los grupos etarios, con la finalidad de alcanzar las metas 90-90-90 incluyendo la calidad de vida en la población infantil, recomendando como esquema preferente en niños mayores de 6 años y 14 kg de peso a Dolutegravir (DTG), y a partir de los 20 kg 50 mg como la población adulta.13 Como respuesta a esta necesidad se desarrollaron inicialmente las presentaciones pediátricas de comprimidos de 10 y 25 mg de DTG para mayores de 6 años de edad y 14 kg de peso, y recientemente la tableta de 5 mg dispersable en agua la cual está indicada en mayores de 4 semanas de vida y 3 kg de peso.
Los estudios que avalan la eficacia y seguridad de estas presentaciones pediátricas son IMPAACT P1093 y ODYSSEY. IMPAACT (International Maternal Pediatric Adolescent AIDS Clinical Trials) Network P1093 evaluó la farmacocinética, seguridad, tolerabilidad y actividad antirretroviral de DTG, estableciendo las dosis de tratamiento para población infantil y adolescentes. Se trata de un estudio fase I/II, abierto, no aleatorizado, multicéntrico de DTG + backbone (o esqueleto) optimizado, de niños entre 4 semanas y <18 años por cohortes.
Cohorte I: Adolescentes con experiencia a tratamiento de 12 a <18 años. Cohorte IIA: niños de 6 a <12 años. Se establece una dosis de 1mg/kg una vez al día de DTG, con lo que se presenta AUC0-24 (37-67µg.h/mL) y C24 (0.77-2.26 µg/mL) sin requerir modificación o ajuste a la dosis. En la semana 48, el 74% de la cohorte I y el 78% de la cohorte IIA alcanzaron ≤400 copias/mL; el 61% y el 74% alcanzaron <50c/mL. El perfil de seguridad fue similar a lo observado en adultos, DTG fue generalmente bien tolerado sin eventos adversos grado 4 y no se reportaron descontinuaciones asociadas a eventos adversos a la semana 48.
Las cohortes IIB (6 – ≤12 años), III (2-<6 años), IV (6 meses – <2 años) y V (4 semanas – <6 meses) utilizaron la presentación dispersable de 5mg, a una dosis: ~1.2 mg/kg una vez al día. DTG fue bien tolerado. A la semana 48 el 91.2% de los participantes presentaban <400 c/mL de VIH-1, y 67.6% <50 c/mL, con una mediana de CD4 243 cel/mm3.
ODYSSEY (Desarrollado por fundación PENTA – Red científica internacional, independiente enfocada en la salud de la infancia) es un estudio fase II/III, abierto, aleatorizado, multicéntrico, no inferioridad de DTG + 2 NRTIs (análogos nucleósidos inhibidores de transcriptasa inversa) Vs SoC (Standard of Care /tratamiento estándar) en <18 años, divididos los participantes en dos grupos: Naïve (ODYSSEY A DTG o EFV (Efavirenz), backbone ABC (Abacavir) + 3TC (Lamivudina) O TDF (Tenofovir disoproxil fumarato) + XTC (lamivudina o emtricitabina)) o Switch a una segunda línea (ODYSSEY B DTG, LPV/r (Lopinavir/ritonavir) o ATV/r (Atazanavir/ritonavir) + backbone ABC + 3TC, TDF+ XTC, ZDV (Zidovudina) + 3TC). En la población general, DTG + 2 NRTI fue superior a SoC en la semana 96 en niños a partir de 4 semanas de vida y 3 kg de peso, la diferencia en la proporción de participantes con fracaso virológico o clínico: -8% (p=0.004), la proporción de eventos adversos ≥1 o grado ≥3 fue similar en ambos brazos y se reportaron menor cantidad de eventos adversos que llevaron a modificar el tratamiento antirretroviral con DTG que con SoC. En este estudio se realizó un análisis en donde se establece la seguridad de duplicar la dosis de DTG para el tratamiento de tuberculosis. En la cohorte de niños pequeños, el 85% iniciaron DTG en primera línea y el 78% recibieron SoC con LPV/r. El riesgo de falla a tratamiento con DTG fue significativamente menor que en el grupo SoC.
IC/FTC/TAF (Bictegravir/emtricitabina/tenofovir alafenamida) se ha estudiado por cohortes, Cohorte 1 (12-18 años >35kg), cohorte 2 (6-12 años ≥25kg) y Cohorte 3 (≥2 años ≥14 a ≤25kg). Las cohortes 1 y 2 recibieron la formulación de adultos, la cohorte 3 recibió la presentación pediátrica BIC 30mg/FTC 120mg/TAF 15mg) –No disponible en México–. 22-24 Puede encontrarse investigación en desarrollo en población menor de 2 años en: www.clinicaltrials.gov.
La evidencia de Dolutegravir en los últimos 4 años ha permitido la modificación en las recomendaciones de tratamiento antirretroviral en la edad pediátrica, permitiendo que las niñas, los niños y las/los adolescentes que viven con VIH a nivel mundial cuenten con esquemas de alta barrera genética, efectivos, seguros y bien tolerados que permitan: disminuir la brecha para alcanzar no solo el control virológico y mejoría inmunológica, mejorar la calidad de vida en una enfermedad proinflamatoria crónica, donde aún quedan tareas pendientes de resolver, como es la toxicidad acumulada, daño a órgano blanco que a diferencia de la población de adultos la cual aún no está descrita en el VIH de transmisión perinatal, estudios de moléculas de depósito, entre otros.
Dentro de la cascada de atención, en México aún se debe trabajar para el diagnóstico oportuno de las mujeres que viven con el VIH para frenar la transmisión perinatal, establecer estrategias para el control de la violencia contra las mujeres y los menores de edad. El diagnóstico de los niños que viven con VIH debe de realizarse en forma temprana y fortalecer los programas para lograr una adherencia óptima, que permita el control de la enfermedad, donde los esquemas antirretrovirales son solo un engranaje de la complicada maquinaria en salud pública que permitirá mejorar la calidad de vida de esta población con múltiples vulnerabilidades.
Recomendaciones Guías de práctica clínica infantiles
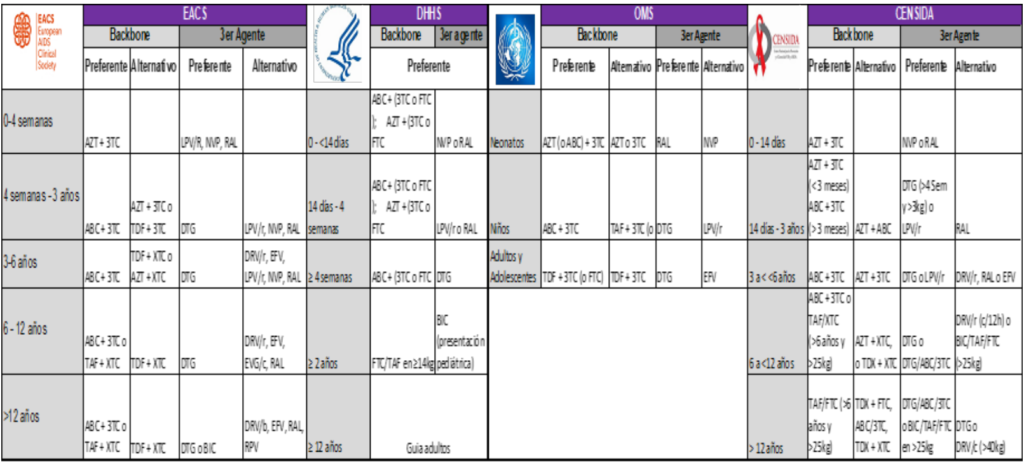
EACS https://eacs.sanfordguide.com/paediatric-hiv-treatment/art-preferred-alternative-first-line-options-formulations-dosing
DHHS https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/pediatric-arv/guidelines-pediatric-arv.pdf
OMS https://www.who.int/publications/i/item/9789240031593
CENSIDA : https://www.gob.mx/censida/documentos/guia-de-manejo-antirretroviral-de-las personas-con-vih-mexico-2021-297710
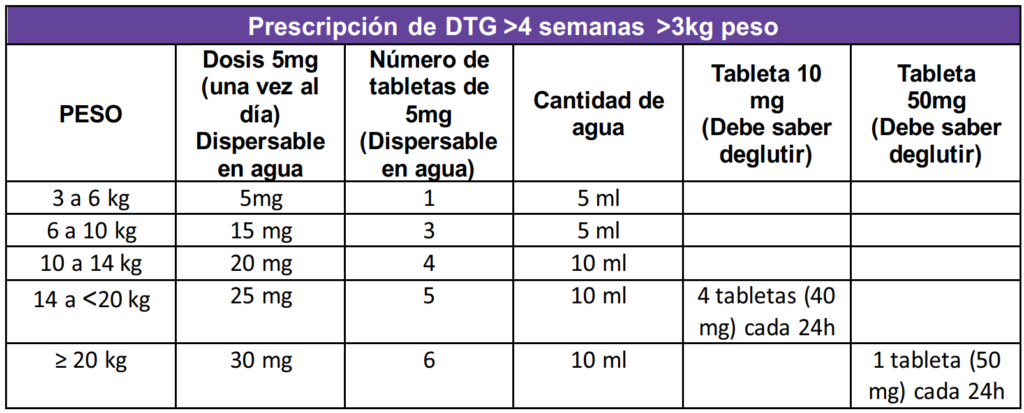
CENSIDA : https://www.gob.mx/censida/documentos/guia-de-manejo-antirretroviral-de-las-personas-con-vih-mexico-2021-297710
Referencias
- HIV data and statistics. WHO https://www.who.int/teams/global-hiv-hepatitis-and-stis-programmes/hiv/strategic-information/hiv-data-and-statistics Consultado: 05 Abril 2023.
- The Global HIV/AIDS Epidemic https://www.hiv.gov/hiv-basics/overview/data-and-trends/global-statistics/ Consultado: 05 Abril 2023.
- ONUSIDA Children https://www.unaids.org/es/keywords/children Consultado: 05 Abril 2023.
- The Global Health Observatory https://www.who.int/data/gho/data/indicators/indicator-details/GHO/reported-number-of-children-receiving-antiretroviral-therapy Consultado: 05 Abril 2023
- HIV, Estimated antiretroviral therapy coverage among children https://www.who.int/data/gho/data/indicators/indicator-details/GHO/estimated-antiretroviral-therapy-coverage-among-children Consultado: 05 Abril 2023.
- Boletín de Atención Integral de Personas con VIH/CENSIDA 202 https://www.gob.mx/cms/uploads/attachment/file/778212/BOLETIN_DAI_DIA_MUNDIAL_DEL_SIDA_.pdf Consultado: 05 Abril 2023
- Informe Histórico Día Mundial VIH 2022 https://www.gob.mx/cms/uploads/attachment/file/782936/Informe-Historico_VIH_DVEET_DIAMUNDIALVIH2022.pdf Consultado: 05 Abril 2023.
- IPAS Latinoamérica y el Caribe https://ipaslac.org/uploads/1573155826302_ES_ARCHIVO_1.pdf Consultado: 05 Abril 2023.
- Boletín de Atención Integral de Personas con VIH/CENSIDA 2021 https://www.gob.mx/cms/uploads/attachment/file/684194/BAI_DAI_2021_4.pdf Consultado: 05 Abril 2023.
- DNDi Launches New Drug Development Programme to Address Treatment Needs of Children with HIV/AIDS https://dndi.org/press-releases/2011/paediatric-hiv/ Consultado: 05 Abril 2023.
- UNAIDS. 2025 AIDS Targets https://aidstargets2025.unaids.org/ Consultado: 05 Abril 2023.
- Herrera C, Maldonado A, Rojas O, et al. Retrospective study of HIV drug resistance in Mexican children with vertically transmitted infection. World J Pediatr. 2002; 18: 505-510. doi: 10.1007/s12519-022-00554-0. Consultado: 05 Abril 2023
- ViiV HEALTHCARE ANNOUNCES US FDA APPROVAL OF THE FIRST-EVER DISPERSIBLE TABLET FORMULATION OF DOLUTEGRAVIR, TIVICAY PD, A ONCE-DAILY TREATMENT FOR CHILDREN LIVING WITH HIV https://viivhealthcare.com/hiv-news-and-media/news/press-releases/2020/june/viiv-healthcare-announces-us-fda-approval-of-the-first-ever-disp/ Consultado: 05 Abril 2023.
- Viani RM, et al. Pediatr Infect Dis J 2015;34:1207–13
- Viani RM, et al. CROI 2014. Abstract 901
- Wiznia AA, et al. CROI 2016. Poster 816
- Ruel T, Acosta E, Liu J, et al. Pharmacokinetics, safety, tolerability and antiviral activity of dolutegravir dispersible tablets in infants and children with HIV: results on the IMPAACT P1093 study, a phase I/II open-label trial. Lancet HIV, 2022; 9: e332-e340. doi:10.1016/S2352-3018(22)00044-3.
- Turkova A. CROI 2021 Abstract 174
- Amuge P, Lugemwa A, Wynne B, et al. Once-daily dolutegravir-based antiretroviral therapy in infants and children living with HIV from age 4 weeks: results from the below 14kg cohort in the randomized ODYSSEY trial. Lancet HIV 2022; 9: e638-648. DOI:https://doi.org/10.1016/S2352-3018(22)00163-1
- Gaur AH, Cotton MF, Rodriguez CA, et al. Fixed-dose combination bictegravir, emtricitabine, and tenofovir alafenamide in adolescents and children with HIV: week 48 results of a single-arm, open-label, multicentre, phase 2/3 trial. Lancet Child Adolesc Health. 2021;5(9):642-651.
- Gaur A, Rodriguez C, McGrath, EJ, et al. Bictegravir/FTC/TAF single-tablet-regimen in adolescents: week 24 results. Presented at: Conference on Retroviruses and Opportunistic Infections. March 4–7; 2018. Boston, MA.
- Cotton M, Liberty A, Rodriguez CA, et al. Pharmacokinetics, safety, and efficacy of bictegravir/emtricitabine/tenofovir alafenamide (B/F/TAF) single-tablet regimen in HIV-1-infected children (6 to <12 years) Presented at: International AIDS Conference 2018.Amsterdam, Netherlands.
- Rodriguez C, Chokephaibulkit K, Liberty A, et al. Safety, PK, and efficacy of low dose B/F/TAF in children ≥2 years old living with HIV. Presented at: Conference of Retroviruses and Opportunistic Infections; 2020. Boston.