Antecedentes
El virus de la viruela símica (monkeypox) es un virus zoonótico perteneciente al género Orthopoxvirus. El primer caso en humanos fue descrito en 1970 en República Democrática del Congo y desde entonces se han reportado brotes relacionados tras el contacto con reservorios salvajes, principalmente roedores; África es el continente más afectado, aunque algunos brotes y casos se han documentado fuera de este continente. 1 La familia Poxviridae son virus de doble cadena de ácido desoxirribonucleico (DNA) 2, muchas especies de poxvirus causan infecciones en los humanos como: viruela, varicela, viruela símica, molusco contagioso, entre otras. Existen dos clados del virus, el clado de la Cuenca del Congo (clado I, África Central) y el clado de África occidental (clado II), 3 éste último relacionado con una enfermedad más autolimitada y con una tasa de letalidad aproximada entre 3-6%; mientras que el de África Central se ha asociado históricamente con mayor transmisibilidad y una tasa de letalidad del 10%. El único país donde se encuentran ambos clados hasta ahora es Camerún. 2
Brote 2022 y el escenario en México
A inicios de mayo de 2022 se reportaron los primeros casos del brote actual en Reino Unido y otros países donde la enfermedad no es endémica; posteriormente varios países de Europa reportaron casos de manera creciente. Los casos aumentaron, afectando cada vez más países y el 23 de julio de 2022 la Organización Mundial de la Salud (OMS) declaró al brote de viruela símica como emergencia de salud pública de importancia internacional. 4 De acuerdo al reporte de la OMS, hasta el 22 de agosto de 2022 existen 41,664 casos confirmados por laboratorio y 192 casos probables con 12 muertes registradas a nivel mundial. Al 23 de agosto del 2022 en México se han confirmado 386 casos, 862 casos probables, 172 casos en estudio y 0 muertes; de los casos reportados 97% son hombres. 5,6 Actualmente la mayoría de los casos notificados no tienen ningún vínculo relacionado con viajes a un país endémico y la mayor incidencia es entre hombres que tienen sexo con hombres (HSH). En un estudio multinacional realizado por Thornhill y colaboradores, se analizaron 528 casos confirmados de esta infección, de los cuales 99% eran hombres, 96 % eran HSH y una mediana de edad de 38 años; de estos, 41% tenía infección por el virus de inmunodeficiencia humana (VIH). 1,2
Cuadro clínico
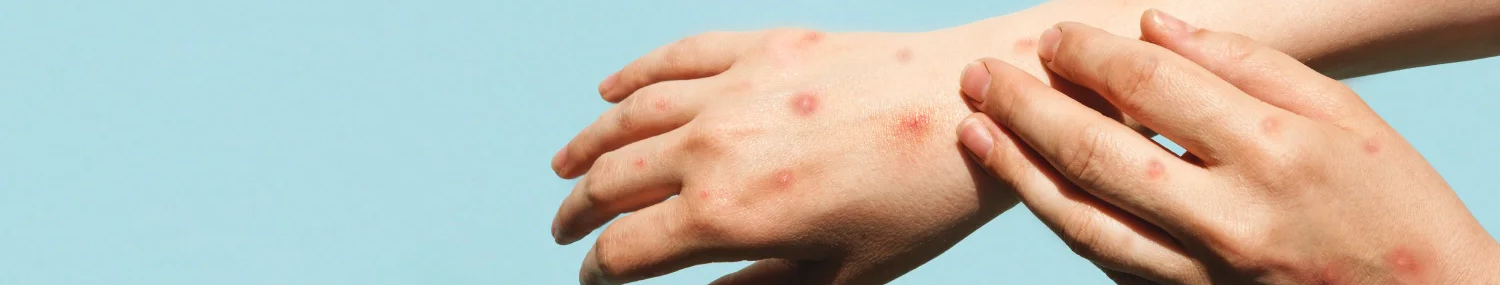
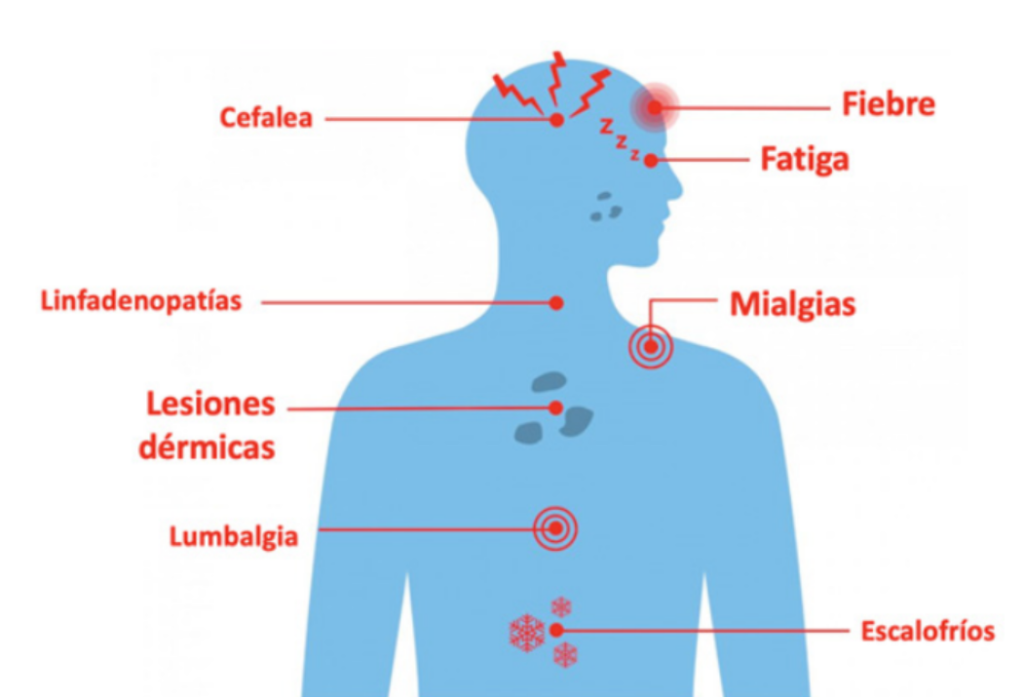
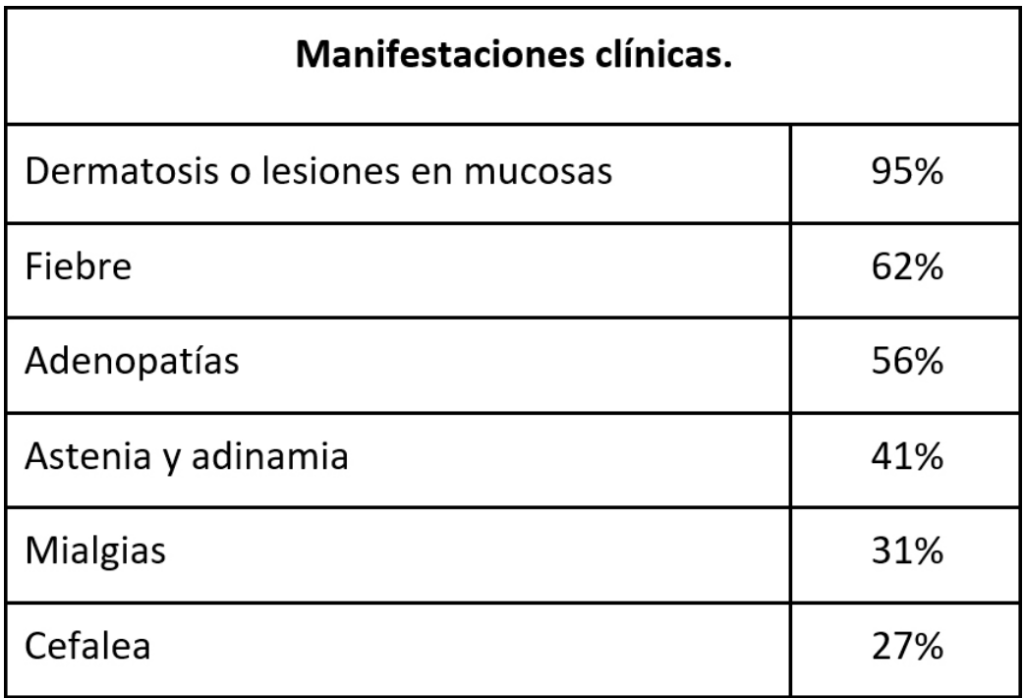
El periodo de incubación es de 5 a 21 días. La presentación clásica son síntomas y signos prodrómicos que incluyen fiebre, cefalea, escalofríos, mialgias, malestar general, linfadenopatías seguido de un exantema característico, que, en los casos de zonas endémicas, inicia usualmente en la boca, y se expande a cara y extremidades incluyendo palmas y plantas. Las lesiones iniciales suelen ser máculas que progresan a pápulas, vesículas, pústulas y costras, pudiendo coexistir lesiones en diferentes etapas. Suelen presentarse en una cantidad variable (10-150 lesiones), pueden ser dolorosas o pruriginosas, con presentación en el sitio de la inoculación, lo que explica que en el brote actual se localicen en la región anogenital de manera predominante. Las úlceras únicas o múltiples se observan con menor frecuencia. Puede encontrarse en algunos pacientes proctitis o faringitis. (Figura 1 y Tabla 1).
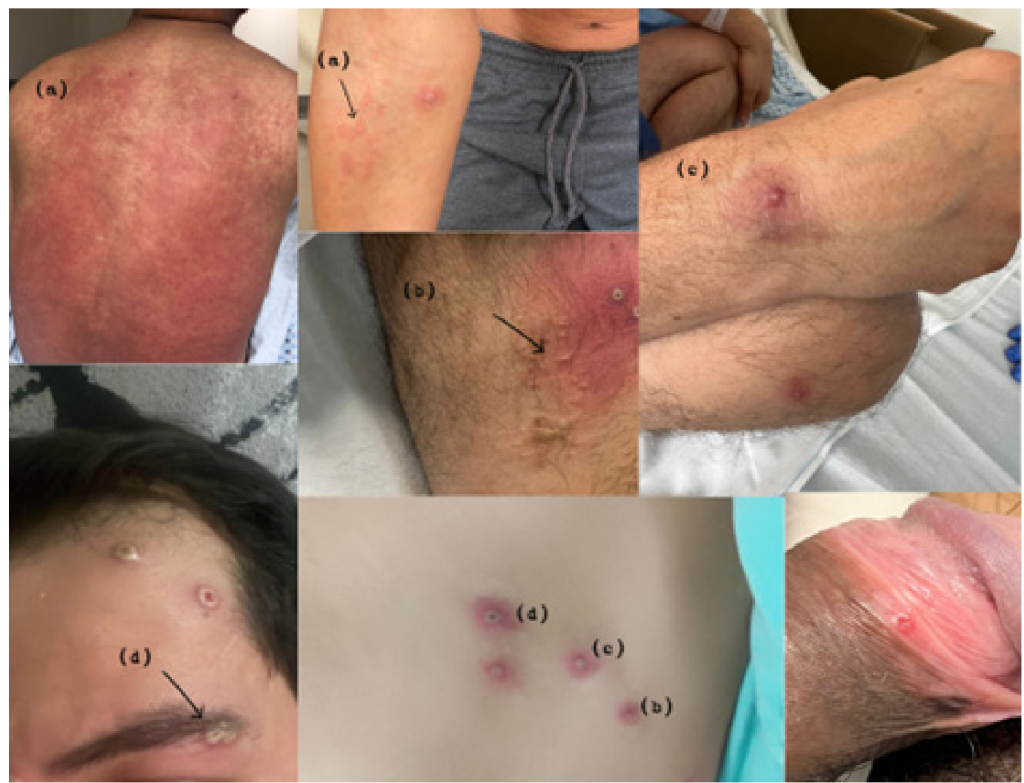
Las complicaciones son poco frecuentes, y la de mayor frecuencia es la sobreinfección bacteriana. En los pacientes inmunocomprometidos o lactantes menores se ha descrito encefalitis, neumonitis, conjuntivitis y queratitis. El brote actual ha presentado características atípicas como limitación al área genital, perigenital, y perianal, además de ausencia de síntomas prodrómicos, o presencia de síntomas de manera simultánea con el exantema, dato originalmente no descrito en la viruela símica endémica de África 1,2,7 (Figura 2).
Transmisión
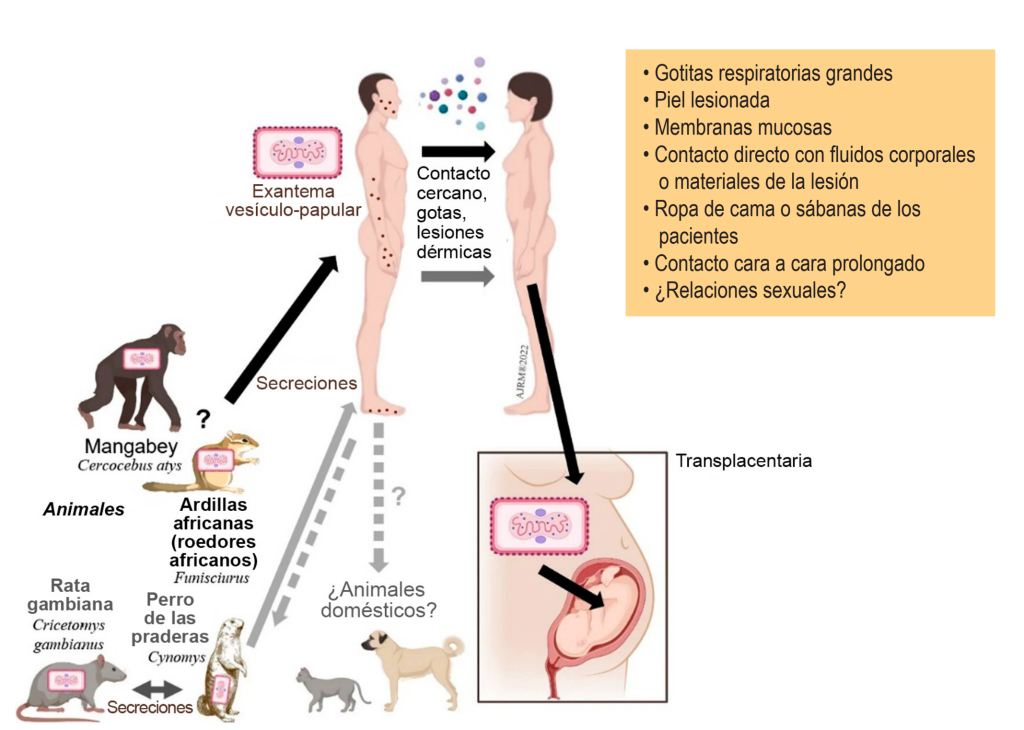
La transmisión zoonótica se produce por contacto directo con animales infectados (sangre, líquidos corporales, lesiones en piel y mucosas) especialmente roedores, que son el reservorio principal. 8 La transmisión de persona a persona, la cual predomina en el brote actual, ocurre por contacto estrecho con las lesiones o con fómites, gotas o secreciones respiratorias y de forma transplacentaria (Figura 3). Se considera que las personas pueden transmitir la enfermedad desde el inicio de los síntomas y hasta que las lesiones cicatrizan, y desaparecen con una nueva capa de piel formada. 1, 2, 7 Se ha propuesto la participación de las secreciones (vaginales, uretrales, semen) como una vía de transmisión, en donde se ha encontrado presencia de material genético viral en el líquido seminal en tres de cada cuatro pacientes estudiados con viruela símica; sin embargo, hace falta mayor evidencia para reconocerlo como
mecanismo de transmisión.9
Diagnóstico
La sospecha diagnóstica inicialmente es clínica. Al encontrarse con alguna lesión compatible se debe realizar una exploración física completa e interrogar antecedentes de viaje, comportamiento sexual, contactos cercanos con casos sospechosos o confirmados de viruela símica; estos datos podrían ayudar en el caso de presentaciones atípicas. El diagnóstico definitivo se realiza mediante la detección de Orthopoxvirus por reacción en cadena de la polimerasa en tiempo real (RT-PCR). De acuerdo a los lineamientos de los Centers for Disease Control and Prevention (CDC), el DNA se puede extraer muestras aceptables que incluyen, líquido de una lesión (vesícula y/o pústula) tomada con hisopo seco, que debe ser enviado en un tubo estéril de policarbonato con tapón de rosca, también puede realizarse la toma de una costra la cual deberá ser colocada en un portaobjetos. Idealmente deben obtenerse muestras de dos lesiones separadas de diferentes partes del cuerpo. Cuando la sospecha diagnóstica sea alta y el paciente no presente lesiones dérmicas visibles, puede tomarse muestra de exudado faríngeo. La serología en búsqueda de anticuerpos para viruela símica no se recomienda porque puede haber reacción cruzada con los vacunados contra viruela, (2) aunque los antígenos virales son detectables a las dos horas posterior a la infección, sólo suelen encontrarse de 8 a 10 a las 8 horas de la infección. 10,11
Hasta agosto 2022, en México el único laboratorio que realiza la detección específica de viruela símica y clado del virus es la Dirección General de Epidemiología a través del Instituto de Diagnóstico y Referencia Epidemiológicos (InDRE) y la Red Nacional de Laboratorios de Salud Pública (RNLSP) mediante amplificación de ácidos nucleicos con RT-PCR.12
Tratamiento
Existen medicamentos antivirales que presentan actividad contra el virus de la viruela y la viruela símica; actualmente ninguno de ellos ha sido aprobado por la Food and Drug Administration (FDA) para su uso. La limitada experiencia clínica de su empleo en pacientes con viruela símica sólo se ha documentado en series de casos. Hasta la fecha no se cuenta con ensayos clínicos que avalen su eficacia y perfil de seguridad para emitir
una recomendación de tratamiento.
Cidofovir
Nucleótido monofosfato análogo de la citosina, el cual actúa mediante la inhibición selectiva de la síntesis del ADN viral. Aprobado por la FDA para el tratamiento de retinitis por Citomegalovirus (CMV) en PPVIH. (2) A pesar de que se ha demostrado su actividad in vitro contra el virus de la viruela símica (MPXV), no existen datos disponibles sobre su eficacia en el tratamiento de casos humanos.13 Los efectos adversos son neutropenia, nefrotoxicidad y síntomas gastrointestinales.2
Brincidofovir
Análogo de nucleótido aprobado por la FDA para tratamiento de la viruela humana, con eficacia demostrada contra MPXV en modelos murinos. (14) A diferencia del cidofovir, el brincidofovir ha demostrado tener un mejor perfil de seguridad renal.15 En una serie de casos en Reino Unido, este fármaco fue utilizado en tres pacientes (200 mg semanales, vía oral), teniendo que suspenderse en todos debido al desarrollo de transaminasemia. 7
Tecovirimat
Antiviral que inhibe la actividad de la proteína p37, con lo cual se impide la síntesis de viriones y evita la replicación y diseminación dentro del hospedero.16 Fue aprobado por la FDA para el tratamiento de la viruela humana y actualmente se encuentra en investigación para el tratamiento de la viruela símica. En estudios preliminares, fue administrado por vía oral a 25 pacientes en California por 14 días, con resultados favorables, adecuada tolerancia y con efectos adversos mínimos reportados al día 7 de uso, tales como cefalea, náusea, prurito, diarrea y fatiga.17 Sin embargo, no puede ser establecido si estos efectos reportados como adversos, resultan ser parte del mismo cuadro clínico producido por la infección. Otros estudios demuestran que disminuye el tiempo de aclaramiento viral con mejoría de la dermatosis, y su principal efecto adverso es el aumento de transaminasas. 7,18 Actualmente el pilar del tratamiento de esta infección se basa en la reposición hidroelectrolítica, debido a la posibilidad de aumento de las pérdidas insensibles (fiebre, diarrea, vómito) y el uso de medicamentos antipiréticos y analgésicos. En algunos casos severos o complicaciones, se deben considerar otras medidas como oxígeno suplementario o tratamiento de sobreinfecciones cutáneas. Los CDC estipulan que se debe considerar la administración de terapia antiviral en caso de enfermedad grave (enfermedad hemorrágica, lesiones confluentes, sepsis, encefalitis u otras afecciones que requieran hospitalización) o en pacientes considerados de alto riesgo de progresión de gravedad (inmunocomprometidos, niños <8 años, embarazadas o lactando, con dermatitis atópica u otras enfermedades exfoliativas de la piel).2,13
Prevención de la viruela símica
Los CDC recomiendan 3 pasos en la prevención de la viruela símica:
- Evitar contacto estrecho piel con piel con personas que tienen exantema o infección sugerente de viruela símica. No tocar el exantema o costras ni besar o tener relaciones sexuales con una persona que tiene viruela símica.
- Evitar contacto con objetos y material que ha usado una persona con viruela símica. No compartir utensilios de comida o tasas, tampoco toallas o ropa de una persona con viruela símica.
- Lavar tus manos frecuentemente. Usar agua y jabón o alcohol gel, especialmente antes de tocarse la cara y después de usar el baño.
La importancia de la vacuna en la prevención de la viruela símica
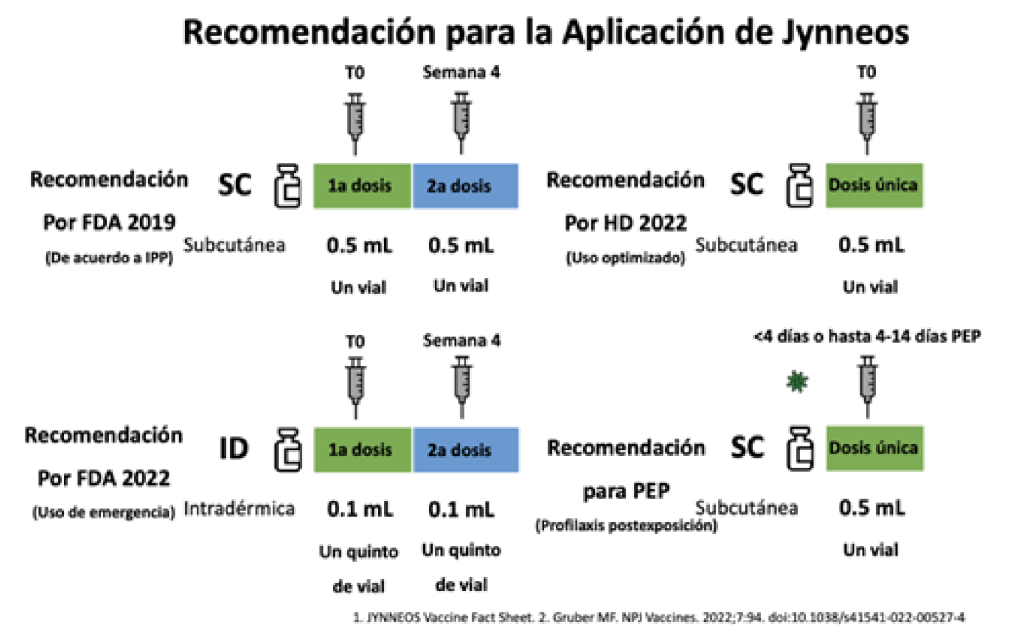
La OMS certificó la erradicación de la viruela en 1980, pero debido a situaciones de riesgo de bioterrorismo y brotes de viruela símica a inicios del siglo 21, se autorizaron vacunas adicionales para la viruela. Actualmente en Estados Unidos de América (EUA) hay 2 vacunas autorizadas para la viruela. ACAM2000, una vacuna replicante basada en virus de segunda generación, aprobada en 2007 por FDA; está indicada para inmunización activa contra viruela, pero no para viruela símica. La otra es Jynneos, una vacuna para viruela de virus atenuados no replicantes de tercera generación que se aprobó por FDA
en 2019. Jynneos fue aprobada en inyección intradérmica para uso de emergencia el 09 de agosto del 2022 por FDA para viruela y viruela símica en adultos ≥18 años que están en alto riesgo para viruela y viruela símica. Debido a su fenotipo atenuado, esta vacuna ha mejorado su perfil de seguridad y puede administrarse a individuos inmunocomprometidos. La efectividad contra la viruela símica se infiere de datos de estudios en animales que demuestran protección contra el virus de la viruela símica en primates no humanos vacunados con esta vacuna y en ensayos clínicos que demostraron su inmunogenicidad en humanos. La eficacia de Jynneos para prevenir viruela símica es mayor del 85%.
Se han iniciado programas de vacunación donde se ofrece aplicar la vacuna en algunos países de Europa y regiones de América a individuos con exposición de alto riesgo (ej., clínicas de salud sexual que atienden infecciones de transmisión sexual)
Conclusiones
La viruela símica ha salido de su zona endémica, lo que nos recuerda que las enfermedades infecciosas son una amenaza constante para la salud pública. El personal de salud debe conocer esta enfermedad infecciosa para poder identificar oportunamente los casos y ofrecer una atención adecuada. Si bien, actualmente el grupo poblacional más afectado son los HSH, cualquier persona puede adquirir la infección. Los pacientes con inmunocompromiso aparentan ser más vulnerables y la enfermedad es más severa. La perspectiva de la vacuna aún se ve lejana en nuestro país, por lo que son necesarios esfuerzos conjuntos, medidas de prevención y contención a nivel internacional; de lo contrario, el brote continuará a lo que parece una inminente pandemia.
Referencias
1) Thornhill JP, Barkati S, Walmsley S, et al. Monkeypox virus infection in humans across 16 countries – April-June 2022. N Engl J Med [Internet]. 2022; Disponible en: http://dx.doi.org/10.1056/NEJMoa2207323
2) Titanji BK, Tegomoh B, Nematollahi S, et al. Monkeypox: A contemporary review for healthcare professionals. Open Forum Infect Dis [Internet]. 2022;9(7):ofac310. Disponible en: http://dx.doi.org/10.1093/ofid/ofac310
3) Koonin EV, Krupovic M, Agol VI. The Baltimore classification of viruses 50 years later: How does it stand in the light of virus evolution? Microbiol Mol Biol Rev [Internet]. 2021;85(3):e0005321. Disponible en: http://dx.doi.org/10.1128/MMBR.00053-21
4) Declaración del Director General de la OMS en la rueda de prensa celebrada tras la reunión del Comité de Emergencias del RSI sobre el brote de viruela símica en varios países – 23 de julio de 2022 [Internet]. Who.int. [citado el 25 de agosto de 2022]. Disponible en: https://www.who.int/es/ director-general/speeches/detail/who-director-general-s-statement-on-the-press-conference-following-IHR-emergency-committee-regarding-the-multi–country-outbreak-of-monkeypox–23-july-2022
5) World Health Organization. 2022 Monkeypox Outbreak: Global Trends [Internet]. Shinyapps.io. [citado el 23 de agosto de 2022]. Disponible en: https://worldhealthorg.shinyapps.io/mpx_global/
6) Gob.mx. [citado el 24 de agosto de 2022]. Disponible en: https://www.gob.mx/cms/uploads/attachment/file/754626/Informe_tecnico_Viruela_Simica_220822.pdf
7) Adler H, Gould S, Hine P, et al. Clinical features and management of human monkeypox: a retrospective observational study in the UK. Lancet Infect Dis [Internet]. 2022;22(8):1153–62. Disponible en: http://dx.doi.org/10.1016/S1473-3099(22)00228-6
8) Viruela símica [Internet]. Who.int. [citado el 25 de agosto de 2022]. Disponible en: https://www.who.int/es/news-room/fact-sheets/detail/monkeypox
9) Antinori A, Mazzotta V, Vita S, et al. Epidemiological, clinical and virological characteristics of four cases of monkeypox support transmission through sexual contact, Italy, May 2022. Euro Surveill [Internet]. 2022;27(22). Disponible en: http://dx.doi.org/10.2807/1560-7917.ES.2022.27.22.2200421
10) Joklik WK. The poxviruses. Annu Rev Microbiol [Internet]. 1968;22(1):359–90. Disponible en: http://dx.doi.org/10.1146/annurev.mi.22.100168.002043
11) Liu B, Panda D, Mendez-Rios JD, et al. Identification of poxvirus genome uncoating and DNA replication factors with mutually redundant roles. J Virol [Internet]. 2018;92(7). Disponible en: http://dx.doi.org/10.1128/jvi.02152-17
12) Gobierno de México. Secretaría de Salud. Guía para el manejo médico de los casos de Viruela Símica en México, 2022.
13) CDC. Treatment information for healthcare professionals [Internet]. Centers for Disease Control and Prevention. 2022 [citado el 25 de agosto de 2022]. Disponible en: https://www.cdc.gov/poxvirus/monkeypox/clinicians/treatment.html
14) Hutson CL, Kondas AV, Mauldin MR, et al. Pharmacokinetics and efficacy of a potential smallpox therapeutic, brincidofovir, in a lethal Monkeypox virus animal model. mSphere [Internet]. 2021;6(1). Disponible en: http://dx.doi.org/10.1128/mSphere.00927-20
15) Florescu DF, Keck MA. Development of CMX001 (Brincidofovir) for the treatment of serious diseases or conditions caused by dsDNA viruses. Expert Rev Anti Infect Ther [Internet]. 2014;12(10):1171–8. Disponible en: http://dx.doi.org/10.1586/14787210.2014.948847
16) Yang G, Pevear DC, Davies MH, et al. An orally bioavailable antipoxvirus compound (ST-246) inhibits extracellular virus formation and protects mice from lethal orthopoxvirus Challenge. J Virol [Internet]. 2005;79(20):13139–49. Disponible en: http://dx.doi.org/10.1128/JVI.79.20.13139-13149.2005
17) Desai AN, Thompson GR 3rd, Neumeister SM, Arutyunova AM, Trigg K, Cohen SH. Compassionate use of tecovirimat for the treatment of Monkeypox infection. JAMA [Internet]. 2022; Disponible en: http://dx.doi.org/10.1001/jama.2022.15336
18) Matias WR, Koshy JM, Nagami, et al. Tecovirimat for the treatment of human Monkeypox: An initial series from Massachusetts, United States. Open Forum Infect Dis [Internet]. 2022;9(8):ofac377. Disponible en: http://dx.doi.org/10.1093/ofid/ofac377
19) Edghill-Smith Y, Golding H, Manischewitz J, et al. Smallpox vaccine-induced antibodies are necessary and sufficient for protection against monkeypox virus. Nat Med. 2005;11:740-747. doi:10.1038/nm1261
20) Bunge, EM, Hoet B, Chen L, et al. The changing epidemiology of human monkeypox—a potential threat? A systematic review. PLoS Neglected Tropical Dis. 16, e0010141 (2022).
21) Monkeypox Update: FDA authorizes Emergency Use of JYNNEOS Vaccine to Increase Vaccine Supply. https://www.fda.gov/news-events/press-announcements/monkeypox-up-date-fda-authorizes-emergency-use-jynneos-vaccine-increa-sevaccine-supply (2022).
22) Wang H, d’Abreu de Paulo KJI, et al. Monkeypox self-diagnosis abilities, determinantes of vaccination and self-isolation intention after diagnosis among MSM, the Netherlands, July 2022. Euro Surveill. 2022; 27 (33). doi: 10.2807/15607917.ES.2022.27.33.2200603.
23) Moschese D, Farinacci D, Pozza G, et al. Is smallpox vaccination protective against Human Monkeypox? [published online ahead of print, 2022 Aug 22]. J Med Virol. 2022;10.1002/jmv.28077. doi:10.1002/jmv.28077.
24) Gruber MF. Current status of monkeypox vaccines. NPJ Vaccines. 2022;7(1):94. Published 2022 Aug 17. doi:10.1038/s41541-022-00527-4
25) How to protect yourself. Monkeypox preventions steps. https://www.cdc.gov/poxvirus/monkeypox/prevention/protect-yourself.html.