El virus herpes zoster y factores de riesgo
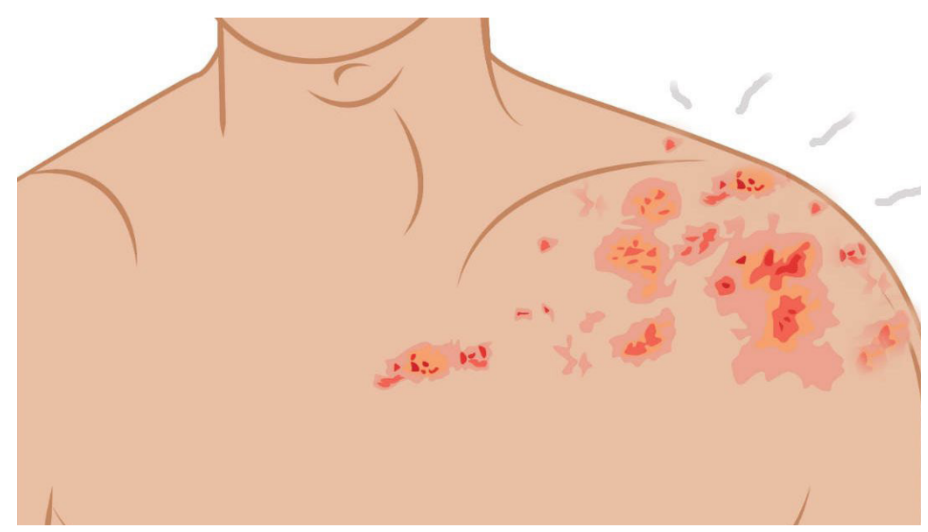
El herpes zoster (HZ), es causado por la reactivación del virus varicela-zoster (VVZ), o herpes virus tipo 3, es un virus con DNA bicatenario que pertenece a la familia de los herpesviridae. El HZ afecta aproximadamente a 1 de casa 3 personas a lo largo de su vida, y el riesgo de HZ aumenta con la edad.1 La infección primaria con VZV causa varicela y una vez que se resuelve la enfermedad el virus permanece en los ganglios de la raíz dorsal. El VVZ puede reactivarse más adelante en la vida de una persona y causar una erupción maculopapular dolorosa, en las que las lesiones se llenan de líquido antes de formar una costra1,2.
Las características únicas que distinguen al HZ de otras erupciones dermatológicas son la presentación unilateral y la restricción a un solo dermatoma en pacientes inmunocompetentes. A través de varios mecanismos, VVZ se reactiva para causar HZ, existen muchas complicaciones incluyendo oftálmicas, vasculares, viscerales y neurológicas. La complicación debilitante más común del HZ es el dolor neuropático crónico de la neuralgia postherpética (NPH), dolor que persiste durante 90 días o más después del inicio del cuadro agudo, esto ocurre en el 20% de los pacientes con HZ.2,3
Numerosos estudios han identificado factores de riesgo asociados a la reactivación del VVZ, muchos de los cuales están relacionados con la disminución de la inmunidad de las células T, como el envejecimiento y la inmunosupresión, pero algunos están relacionados con antecedentes familiares o estrés.4
En un metanálisis se reportó que la inmunosupresión como en el caso de VIH/SIDA o cáncer coloca a las personas en un riesgo significativo de reactivar su virus latente. Los antecedentes familiares de HZ, el traumatismo físico y la edad avanzada también aumentan significativamente el riesgo.
Otros factores que se han asociado son el sexo femenino, el estrés psicológico y la presencia de comorbilidades, como diabetes, artritis reumatoide (AR), evento vascular cerebral (EVC), enfermedad renal crónica (ERC) y lupus eritematoso sistémico (LES).2
El riesgo elevado en los pacientes mayores se debe a la inmunosenescencia, en la que el sistema inmunológico se deteriora progresivamente a medida que las personas envejecen.5
Actualmente, hay dos vacunas para la prevención del HZ, ambas autorizadas por FDA y COFEPRIS, una es vacuna de virus vivos atenuados y la segunda una vacuna recombinante con adyuvante (RZV); ambas vacunas aumentan la inmunidad mediada por células. La vacuna de virus vivos atenuados, no es ampliamente recomendada para HZ ya que la eficacia de la vacuna después de 3 años disminuye al 50% y disminuye aún más a <24% después de 4 años; además de que no es recomendada para paciente con inmunocompromiso. La RZV contiene el antígeno de la glucoproteína E del virus de la varicela zoster y el adyuvante AS01B, una tecnología dirigida especialmente a personas con inmunosenescencia e inmunocompromiso; esta última autorizada para la prevención de HZ y NPH en adultos ≥50 años y más y todos los adultos ≥18 años y más con riesgo incrementado de padecer la enfermedad. La seguridad y eficacia de esta vacuna ha sido demostrada en ensayos clínicos en adultos inmunocompetentes, en personas inmunocomprometidas seleccionadas y con enfermedades inmunomediadas.1,6
Comorbilidades y el riesgo de infección por Herpes Zoster
Varias condiciones clínicas pueden causar una reactivación del VVZ sobre todo en personas ≥50 años, con una prevalencia en este rango del 45% en pacientes mayores de 60 años y del 65% en mayores de 70 años, para los mayores de 85 años el riesgo aumenta a una de cada dos personas.7 El envejecimiento está asociado a un aumento importante en las comorbilidades y polifarmacia lo que puede favorecer la reactivación, sobre todo en aquellas que comprometen el sistema inmunológico, dentro de estas se pueden incluir enfermedades reumatológicas como AR, LES, enfermedad inflamatoria intestinal (EII), condiciones crónicas como diabetes, enfermedad pulmonar obstructiva crónica (EPOC), ERC, asma y depresión.8 El uso de estatinas también se han encontrado como un factor de riesgo para desarrollar HZ, en los adultos mayores de 70 años se ha encontrado que tienen un riesgo 39% mayor comparados con un grupo de la misma edad que no recibe estatinas (p=0.003) esto también se ha relacionado con la duración del uso de estatinas.9
Las enfermedades autoinmunes, incluidas AR y LES, se asociaron con un riesgo casi dos veces mayor de HZ, con tasas de incidencia de 8 a 15 por 1000 personas-año.10 Por otro lado es ya conocido que los padecimientos inmunosupresores como el virus de inmunodeficiencia humana (VIH) y las neoplasias malignas aumentan el riesgo de infecciones virales, como el HZ; en general, esta asociación con el VIH está dada cuando los niveles de CD4+ se presentan por debajo de 200 células/mm3, esto se observa con mayor frecuencia en hombres que tienen sexo con hombres (HSH) y sobre todo en aquellos que no reciben un tratamiento antirretroviral (TAR) oportuno.11 La diabetes es la primera causa de muerte metabólica en nuestro país y es importante destacar que el riesgo de HZ se ha asociado fuertemente en múltiples estudios, 11% vs 16% (p<0.05). Por otro lado la incidencia de NPH también fue mayor en pacientes con diabetes12, en ellos el riesgo de presentarla es mayor, este es del 10% al 18%.13 La disfunción inmunológica y el desequilibrio de las
citocinas proinflamatorias y antiinflamatorias desempeñan un papel en la reactivación de la infección por VVZ.10 En una cohorte en donde evaluaron el riesgo de HZ en pacientes con enfermedades subyacentes los resultados mostraron que los pacientes que tenían al menos una de las 14 comorbilidades que a continuación se enlistan: tumor cerebral, cáncer de pulmón, cáncer de mama, cáncer de esófago, cáncer gástrico, cáncer colorrectal, cáncer ginecológico, linfoma, LES, AR, diabetes, hipertensión, ERC, y hernia de disco, mostraron un aumento del riesgo de HZ de 1.8 a 8.4 veces en comparación con los pacientes que no la padecían.14 Definitivamente el riesgo de desarrollar HZ es mayor en aquellas personas que cuentan con alguna enfermedad que condicione inmunocompromiso y esto sumado a la asociación de medicamentos inmunosupresores, como la quimioterapia, los corticosteroides en dosis altas y los agentes biológicos incrementa aún más el riesgo.10
Inmunosenescencia e inmunofitness
Se puede definir la inmunofitness como la capacidad del cuerpo a responder a cambios en la salud por activación de una respuesta inmune apropiada en orden de promover la salud y resolver la enfermedad, la cual es esencial para mejorar la calidad de vida.15 La inmunosenescencia es el resultado del deterioro de los sistema homeostáticos encargados de preservar la salud del organismo, la disminución natural y progresiva que experimentan esos sistemas se debe al establecimiento de una situación de estrés oxidati- vo que conduce a una inflamación crónica de bajo grado.16
Los mecanismos de Inmunosenescencia están ligados al deterioro del sistema inmunológico, a edades tempranas se presenta una producción de linfocitos vírgenes, gran diversidad de linfocitos, adecuada funcionalidad de las células efectoras, proliferación linfocítica y adecuados títulos de anticuerpos post vacunación pero conforme avanza la edad notamos una menor diferenciación linfocitaria, hay desregulación en la producción de citocinas, fibrosis en los nódulos linfáticos y aumenta la susceptibilidad a las enfermedades infecciosas.17 Se ha observado que el efecto de la vacunación contra influenza en el envejecimiento tiene un beneficio modesto en la disminución de hospitalizaciones y muerte después de los 65 años, esto se debe a la menor respuesta del sistema inmune a la vacunación en los adultos mayores.18 La epigenética se entiende como la diferenciación celular a través del cual los genotipos resultan en fenotipos. Los grupos metílicos activan o desactivan genes al perturbar las interacciones entre el DNA y otras proteínas, guiadas por estas proteínas las células pueden recordar qué genes están activados o desactivados y afectan directamente el DNA.19 La activación de la inmunidad innata por infecciones o vacunación deja en las histonas modificaciones y una reprogramación funcional de las células (como monocitos, macrófagos o células NK) llamado “entrenamiento inmunológico” o “memoria inmune innata” que incluye estados adaptativos para proteger al hospedero durante una colonización por microorganismos o después de una infección; sin embargo, en ciertas situaciones, el entrenamiento inmunológico puede resultar en un estado de mala adaptación como en una parálisis inmune post sepsis o en una hiperinflamación.20 Por lo cual podríamos concluir que la inmunosenescencia genera disminución en la eficiencia del sistema inmune para responder a las infecciones y a las vacunas, lo que lleva a estados hiperinflamatorios o de tolerancia inmunológica. La mejoría en estas respuestas depende del estilo de vida, ejercicio, dieta y vacunas. Las nuevas tecnologías en vacunación están dirigidas a optimizar la respuesta inmunológica a las vacunas ante el impacto de la edad sobre el sistema inmune a enfermedades específicas.
Vacunación en poblaciones especiales
Vacuna RZV en pacientes con trasplante de órgano sólido (TrOS)
En México el número de TrOS se ha incrementado en relación con los años previos a pesar de la pandemia, de agosto del 2020 a abril del 2021 se llevaron a cabo 125 trasplantes de riñón de donante fallecido, 429 de donante vivo; de hígado, 39 de donante fallecido contra 8 de vivo; de corazón se realizaron 4 y pulmón 4 según fuentes del Centro Nacional de Trasplantes [CENATRA]22 , este incremento en el número de trasplantes, la mejora en la terapia inmunosupresora y el manejo postrasplante han incrementado la sobrevida del injerto lo que aumenta el tiempo de vida de estos pacientes con una constante inmunosupresión23.
La incidencia de HZ es hasta 9 veces mayor en población con inmunosupresión con TrOS comparado con la población general, un análisis multicéntrico de la cohorte de veteranos de Estados Unidos mostró una incidencia de HZ de 22.2 por 1000 pacientes-año [95%IC 25.0-56.6], teniendo un mayor riesgo en individuos Afro-Americanos (Hazard Ratio [HR] 1.88; 95%IC: 1.12, 3.17), receptores de trasplantes de mayor edad (HR 1.13; 95% IC 1.01, 1.27 [por 5 años de incremento])21.
Los receptores de TrOS tiene una inmunodeficiencia mixta, pero predomina la celular que condiciona una inmunosupresión crónica24.
Aunque la eficacia de diferentes vacunas en receptores de TrOS es en ocasiones subóptima, la inmunización en contra de enfermedades infecciosas comunes es actualmente recomendada en pacientes con TrOS. Mientras que la infección natural por el VVZ pudiera estimular el sistema inmune e incrementar el riesgo de rechazo, existe una muy limitada evidencia de una correlación entre la vacunación y rechazo del aloinjerto24.
La vacuna de virus atenuados está actualmente contraindicada en individuos inmunosuprimidos, incluyendo TrOS.25 La RZV ya aprobada por la FDA y COFEPRIS, es la opción para prevenir HZ en TrOS. En una cohorte retrospectiva de 65 pacientes con trasplante de corazón vacunados entre septiembre 2019 a julio del 2019 que se les administró RZV en forma intramuscular (IM) con dos dosis de separación por hasta 2 meses, la vacuna fue bien tolerada en todos los pacientes, los eventos adversos reportados, en su mayoría reacciones en sitio de administración, ocurrieron en 35% de los pacientes (n=23) después de la primera administración IM y 28% de los pacientes (n=13) después de la segunda dosis, siendo la mayoría de los eventos adversos reacciones en el sitio de administración. No existió evidencia de recha- zo del injerto25.
Recientemente el resultado de la fase 3 de vacunación en pacientes con trasplante renal mostró un buen perfil de seguridad y una robusta respuesta de la inmunidad humoral y celular. La mayoría de reacciones adversas que fueron reportadas en este ensayo clínico fueron reacciones locales en el sitio de administración y ningún evento adverso grave fue reportado relacionado con la vacunación; tampoco se describieron rechazos del aloinjerto hasta 30 días después de la segunda dosis de la vacuna. La principal fortaleza de este estudio es que fue un ensayo clínico controlado en población trasplantada y su principal limitante fue que se desarrolló en un número limitado de regiones y como consecuencia existe una limitada heterogeneidad racial26.
Serán necesarios más estudios que incluyan una población más heterogénea en una población con alto riesgo de HZ debido a inmunosupresión crónica por TrOS.
Vacuna RZV en pacientes con trasplante de médula ósea
El riesgo de HZ aumenta después del trasplante autólogo de células madre hematopoyéticas (TCMH), debido a la disminución de la inmunidad de las células T, con una incidencia máxima durante el primer año posterior al TCMH, el HZ puede dar lugar a una infección diseminada de alta morbilidad y puede tener complicaciones adicionales hasta en un tercio de los casos27,28. La vacunación tiene el potencial de brindar protección a largo plazo contra el HZ, 29,30
la RZV no tiene riesgo asociado de desencadenar la infección en adultos sanos ni personas con inmunocompromiso, esta vacuna redujo significativamente el riesgo de HZ en adultos sanos de al menos 50-70 años (eficacia de la vacuna de 91% en adultos ≥18 años); y demostró una eficacia para prevenir la enfermedad en pacientes que recibieron un TCMH de 68.2%. 84./% para prevenir NPH y 84.7% para evitar hospitalizaciones relacionadas a la infección.31,32
Debido a que el sistema inmunológico es inmaduro después de la infusión de células madre y en regímenes intensivos de acondicionamiento administrados antes del TCMH, los pacientes no pueden generar una respuesta inmunológica protectora adecuada a las vacunas administradas poco después del trasplante. La vacuna administrada en 4 dosis (1 antes y 3 después del trasplante) demostró tener eficacia del 64% en la prevención del HZ en pacientes sometidos al TCMH autológo.33 En adultos que se habían sometido recientemente a un TCMH autólogo, se reportó en un estudio que dos dosis de RZV, redujeron significativamente la incidencia de HZ en un seguimiento a 21 meses.34 Un estudio entre receptores de TCMH, reportó que la eficacia para prevenir la enfermedad es de 68.2% e informó una eficacia de la vacuna (RZV) del 89% (IC95% 22%–100%) para la prevención de la NPH y del 85% (IC95% 32%–97%) para la prevención de la hospitalización relacionada con el HZ.35,36 En pacientes con neoplasias malignas hematológicas, un estudio informó sobre la enfermedad de injerto contra huésped entre los receptores de TCMH y no identificó un mayor riesgo entre los que recibieron RZV.36
En todos los estudios que involucraron pacientes inmunocomprometidos se evaluó la seguridad de la vacuna RZV, en general las tasas de EAG fueron comparables entre los que recibieron RZV y los del grupo placebo. Con una efectividad de la vacuna de moderada a alta en los pacientes inmunocomprometidos y un perfil de seguridad aceptable, la RZV tiene el potencial de prevenir una incidencia considerable de HZ y complicaciones relacionadas.37
Vacuna RZV en personas que viven con VIH
La incidencia de HZ puede ser hasta 10-20 veces más alta en personas que viven con VIH (PVVIH) respecto a personas sin VIH y el HZ puede ocurrir en PVVIH con cualquier recuento de células CD4+, pero lfrecuencia es más alta con recuentos de CD4+ <200 células/mm3.38,39
La incidencia de HZ era mayor en la época previa a la TAR. En un estudio de cohorte en la era pre-TAR realizado en San Francisco, EUA, de 287 HSH con fechas bien definidas de seroconversión al VIH y 499 hombres VIH seronegativos, la incidencia de HZ fue significativamente mayor entre los hombres seropositivos a VIH (29.4 casos/1000 personas-año) que entre hombres seronegativos (2.0 casos/1000 personas-año).40
En años más recientes, en los que ya se cuenta con una TAR efectiva, la incidencia ha disminuido.
Un estudio dirigido por la Universidad Johns Hopkins identificó una tasa de incidencia de 9.3/1000 personas-año, pero continua por arriba a la reportada en la población general. Cincuenta pacientes (28%) tenían HZ complicado y el 12% desarrolló NPH. En un análisis multivariado, los factores asociados con el aumento del riesgo de HZ fueron haber iniciado TAR recientemente, <90 días antes del evento de HZ (Adjusted OR 4.02, 95% CI 1,3-12,4), una carga viral RNA VIH-1 de >400 copias/mL (Adjusted OR 1.49 95% IC 1.0-2.2), y cuenta de CD4+ <350 células/mm3 (Adjusted OR 2.46, 95% CI 1.4-4.2). Es frecuente en síndrome de recons titución inmune.41
En otro reporte francés, de cohorte retrospectiva, se observó disminución de la incidencia de HZ en últimos años en PVVIH. Los casos de HZ se asociaron con recuentos bajos de células CD4+, niveles altos de carga viral RNA VIH-1, proporciones bajas de CD4+/CD8+ y alguna condición pre- via de síndrome de inmunodeficiencia adquirida (SIDA). En comparación con la población general, el riesgo de HZ fue mayor en las PVVIH, en particular los de 15 a 44 años.42
Las complicaciones debidas a HZ pueden ser más frecuentes en PVVIH. Se ha encontrado que las complicaciones son más frecuentes en esta población respecto a personas sin VIH. La complicación más frecuente fue NPH en 18% de los pacientes; otras complicaciones frecuentes fueron sobreinfección bacteriana, complicaciones oculares y afección ótica.43
Los CDC (Centers for Disease Control and Prevention) asumen que las PVVIH tienen un alto riesgo de HZ y sus complicaciones relacionadas, por lo que deberían vacunar se contra HZ. Los NIH (The National Institutes of Health)/IDSA (Infectious Diseases Society of America)/CDC recomiendan la RZV contra el HZ para todas las PVVIH de 18 años y más, independientemente de la cuenta de células CD4+. Desde 2022, la ACIP (Advisory Committee on Immunization Practices) en Estados Unidos, recomienda la vacuna RZV en adultos con VIH (CD4 <200 células/mm3 o 15% y CD4 >200 células/mm3 o 15%); 2 dosis (2-6 meses de diferencia) a la edad ≥19 años44.
Debido a la incidencia aún mayor en PVVIH y posibles complicaciones, la Sociedad de Investigación y Docencia en Virología e Infectología considera necesaria la vacunación contra HZ en PVVIH con RZV; y que aún son necesarios ensayos clínicos para evaluar la eficacia y seguridad en esta población específica que permitan recomendaciones homogéneas.
Vacuna RZV en pacientes con enfermedad autoinmune inflamatoria
Los pacientes con enfermedad autoinmune inflamatoria (EAI) tienen un incremento en la carga de enfermedad para infecciones, atribuido a la enfermedad autoinmune subyacente, las comorbilidades y la terapia inmunosupresora.45,46 La reactivación de infecciones latentes es otro problema asociado a la terapia inmunosupresora47. Tanto la EAI como los fármacos modificadores de la enfermedad (FARMEs) pueden detonar que el virus entre en fase replicativa y causen infección48. En pacientes con AR, el riesgo de reactivación de HZ se incrementa 2 a 3 veces49. Con algunos FARMEs se ha visto incrementado el riesgo de HZ, tal es el caso de inhibidores del JAK, incluyendo mayor severidad de la infección50. Se ha comparado el riesgo de HZ entre tofacitinib y otros bFARMEs. La tasa cruda (IC 95%) de HZ en AR en pacientes que inician tofacitinib (n = 2526) fue 3.87 (2.82, 5.32), para los otros biológicos la tasa cruda en AR fue de 1.95 (1.65, 2.31) para adalimumab a 2.71 (2.33, 3.08) para infliximab51.
La vacunación previene las infecciones por inducir y/o aumentar la inmunidad protectora. La vacunación es particularmente importante en pacientes con EAI, esto se ve reflejado en una menor frecuencia de hospitalizaciones a causa de infecciones, ingresos a sala de urgencias y menos infecciones invasivas52 Una vacuna de virus vivos atenuados se aprobó por FDA en 2006, para prevención de adultos de 60 años o más; aunque la eficacia de la vacuna difiere entre grupos de edad, la eficacia fue del 51% y no puede usarse en pacientes que toman concomitantemente inmunosupresores; en 2017 se aprueba por FDA RZV que es más efectiva que la anterior y si puede usarse en pacientes con EAI y uso de FARMEs53.
En pacientes con EAI se reportó un estudio con 403 pacientes (239 con AR y 164 con otras enfermedades reumáticas sistémicas) quienes recibieron la vacuna RZV. Se encontró una incidencia de “flares” en 6.7% (n = 27) y los eventos adversos ocurrieron en 12.7% (n = 51) de los pacientes. Tanto los eventos adversos como los “flares” se consideraron leves. Se reportaron tres casos de HZ y ocurrieron 2, 10 y 11 meses después de la vacunación54. En otro estudio de 7207 sujetos con EAI mayores de 50 años, donde ellos fueron su autocontrol, recibieron al menos una vacuna RZV y 65% recibieron las dos dosis, el riesgo de ”flare” o deterioro de la enfermedad posterior a cada vacuna no se incrementó comparado con ellos mismos en una ventada de 6 semanas previas a la vacunación (9%-12% posterior a la vacunación vs 10%-13% en la ventana de control)55, lo que demuestra que RZV tiene un perfil de seguridad adecuado, además de prevenir las enfermedad y sus complicaciones.
Conclusiones
La eficacia, seguridad e inmunogenicidad de RZV se ha demostrado en en la mayoría de los estudios realizados en adultos inmunocompetentes e inmunosuprimidos. La RZV es la primera vacuna contra HZ aprobada para su uso en personas inmunocomprometidas, con una eficacia en este grupo de pacientes de moderada a alta y un perfil de seguridad aceptable; RZV tiene el potencial de prevenir una incidencia considerable de herpes zoster y complicaciones relacionadas.
Referencias
- Harbecke R, Cohen J, Oxman M. Herpes Zoster Vaccines. J Infect Dis 2021;224:429-442.
- Marra F, Parhar K, Huang B, et al. Risk Factors HerpesZoster Infection: A Meta-Analysis. Open Forum Infect
Dis 2020;7:1-8. - Kennedy P, Gershon A. Clinical Features of Varicella-Zoster Virus Infection. Viruses 2018;10:609.
- Thomas S, Sala A. What does epidemiology tell us about risk factors for herpes zoster? Lancet Infect Dis. 2004;4:26-33.
- Aw D, Silva A, Palmer D. Immunosenescence: emerging challenges for ageing population. Immunology. 2007;120:435-446.
- Dooling K, Guo A, Leung J, et al. Performance of zoster vaccine live (Zostavax): a systematic review of 12 years of experimental and observational evidence. Open Forum Infect Dis. 2017;4:412-413.
- Pinchinat S, Cebrián A, Bricout H, et al. Similar herpes zoster incidence across Europe: Results from a systematic literature review. BMC Infect Dis 2013; 13:170.
- Forbes H, Bhaskaran K, Thomas S, et al. Quantification of risk factors for herpes zoster: population based case-control study. BMJ 2014;13:348.
- Kim M, Yun S, Lee S, et al. Statins increase the risk of herpes zoster: a propensity score-matched analysis. PLoS One 2018;13:1-11.
- Kawai K, Bostezo B. Risk factors for herpes zoster: a systematic review and meta-analysis. Mayo Clinic Proceedings 2017;92:1806-1821.
- Chang H, Tseng Y, Padmalatha S, et al. Incidence of herpes zoster in HIV-infected patients undergoing antiretroviral therapy: a systematic review and meta-analysis. J of Clin Med 2021;10:1-13.
- Mitra E, Bauduceau B, Del-Signore C, et al. Diabetes as a risk factor for herpes zoster in adults: a synthetic literature review. Diabetes Res and Clin Pract 2020;159:107109.
- Harpaz R, Ortega I, Seward J. Advisory Committee on Immunization Practices (ACIP) Centers for Disease
Control and Prevention (CDC). Prevention of herpes zoster: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2018;103-108. - Sombrero U, Kuniyoshi M, Ohkusa Y. Risk of Herpes zoster in patients with underlying diseases: a retros-
pective hospital-based cohort study. Infection 2011;39: 537-544. - https://www.gutmicrobiotaforhealth.com/building-re-silient-immune-system-interview-prof-philip-calder-part-1
- Martínez de Toda I, Ceprián N, Díaz-Del Cerro E, et al. The role of immune cells in oxi-inflamm-aging. Cells
2021;10: 2974. - Crooke S, Ovsyannikova G, Poland A, et al. Immunose nescence and human vaccine immune responses. Immunity & Ageing 2019;16:25.
- Anderson L, Dobkin C, Gorry D. Effect of influenza vaccination for the elderly on hospitalization and morta-
lity. Annals of Internal Medicine 2020;173:322–323. - Villota A, Mendoza A, González M. Epigenetics: from the past to the present. Frontiers in Life Science 2016;9:347–370.
- Netea G, Joosten B, Latz E. Trained immunity: A pro- gram of innate immune memory in health and disease. Science 2016;352:1098.
- Pergam A, Forsberg W, Boeckh J, et al. Herpes zoster incidence in a multicenter cohort of solid organ trans-plant recipients. Transpl Infect Dis 2011;13:15-23
- http://www.cenatra.gob.mx/rnt/
- Álvarez L, Martínez P, Granados L, et al. Supervivencia del paciente y del injerto a largo plazo en receptores de trasplante renal [Long-term patient and graft survival in kidney transplant recipients]. Rev Med Inst Mex Seguro Soc 2019; 57:348-356.
- Cohen JI. Clinical practice: Herpes zoster. N Engl J Med 2013;369:255- 63.
- Barghash H, Taimur S, Rana M, et al. Mancini D. Re- combinant herpes zoster vaccine after heart transplan- tation: A single-center experience. J Heart Lung Transplant 2020;39:1501-1503.
- Vink P, Ramon J, Sanchez A, et al. Immunogenicity an Safety of the Adjuvanted Recombinant Zoster Vaccine in Chronically Immunosuppressed Adults Following Renal Transplant: A Phase 3, Randomized Clinical Trial. Clin Infect Dis 2020;70:181-190.
- Offldani M, Corvatta L, Oliveri A, et al. A predictive model of varicella-zoster virus infection after autolo-
gous peripheral blood progenitor cell transplantation. Clin Infect Dis 2001;32:1422. - Sahoo F, Hill JA, Xie H, et al. Herpes Zoster in autologous hematopoietic cell transplant recipients in the era of acyclovir or valacyclovir prophylaxis and novel treat ment and maintenance therapies. Biol Blood Marrow Transplant. 2017;23:505-511.
- Willis ED, Woodward M, Brown E, et al. Herpes zoster vaccine live: a 10 year review of post-marketing safety experience. Vaccine 2017;35:7231-7239.
- Alexander KE, Tong PL, Macarthey K, Beresford R, et al. Live zoster vaccination in an immunocompromi- sed patient leading to death secondary to disseminated varicella zoster virus infection. Vaccine 2018;36:38903893.
- Lecrenier N, Beukelaers P, Colindres R, et al. Development of adyuvanted recombinant zoster vaccine and its implications for shingles prevention. Expert Rev Vaccine 2018;17:619-634.
- Lal H, Cunningham AL, Godeaux O, et al. ZOE-50 Study Group. Eficacy of and adyuvanted herpes zoster subunit vaccine in older adults. N Engl J Med 2015;375: 2087-2096.
- Winston D, MullaneK M, Cornely A, et al; V212 Protocol 001 Trial Team. Inactivated varicella zoster vaccine in autologous hematopoietic stem-cell transplant recipients: an international, multicentric, randomized, double-blind placebo-controlled. Lancet 2018;391:21162127.
- Bastidas A, Serna J, Idrissi E, et al. Effect of recombinant Zoster Vaccine on Incidence of Herpes Zoster AfterAutologous Stem Cell Transplantation a Randomized Clinical Trial. JAMA 2010;322:123-133. 34
- Stadtmauer A, Sullivan M, Marty M, et al. A phase 1⁄2 study of an adjuvanted varicella -zoster virus subunit vaccine in autologous hematopoietic cell transplant recipients. Blood 2014;124:2921-2929.
- Dagnew F, IIhan O, Lee S, et al. Zoster-039 Study Group. Immunogenicity and safety of adjuvanted recombinantzoster vaccine in adults with hematological malignancies: a phase 3, randomized, clinical trial and post-hocefficacy analysis. Lancet Infect Dis 2019;19:988-1000.
- Dagnew F, Rausch D, Hervé C, et al. ZOE-50/70 study Group. Efficacy and serious adverse events profile of the adjuvanted recombinant zoster vaccine in adults with pre-existing potential immune-mediated diseases: a pooled post hoc analysis on two parallel randomized trials. Reumatolog (Oxford) 2021;60:1226-1233.
- Buchbinder SP, Katz MH, Hessol NA, et al. Herpes zoster and human immunodeficiency virus infection. J Infect Dis 1992;166:1153–1156.
- Donahue JG, Choo PW, Manson JE, Platt R. The incidence of herpes zoster. Arch Intern Med 1995;155:1605–1609.
- Buchbinder SP, Katz MH, Hessol NA, et al. Herpes zoster and human immunodeficiency virus infection. J Infect Dis 1992;166:1153